��Ŀ����
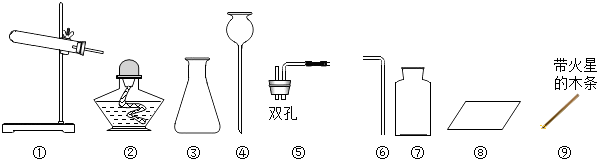
����Ŀ������������������Ӧ�úܹ㷺��һ�ֽ����������������������йصIJ���ʵ��ͼ����ش��������⣮ 
��1��A�з�����Ӧ�Ļ�ѧ����ʽ�� ��
��2��B��������������IJ�����a������b����c������
��3��C�з�Ӧ�տ�ʼʱ����С����ޡ������ݲ�����һ��ʱ���ϡ�������ķ�Ӧ����ʽΪ ��
��4��D�з�Ӧһ��ʱ����Թ��ڹ��������ȷ�Ӧǰ���ݴ��ƶϣ��Թ�����Һ�����뷴Ӧǰ���������������䡱��С������
��5����ҵ�ϳ��ó�������Ҫ�ɷ�Ϊ����������һ����̼���·�Ӧ���������䷴Ӧ�Ļ�ѧ����ʽΪ ��
��6��С��ͬѧΪ̽������ͭ��þ�Ľ������˳����ȡ��Ƭ������ͭ��Һ����һ����Һ��ʵ�飬�����Һ�����ʵĻ�ѧʽΪ��Сѩͬѧ�ѹ��������ۼ��뵽X��NO3��2��Y��NO3��2�����Һ�г�ַ�Ӧ����ˣ�����ֻ������X��������X��Y���ֽ��������ǿ������˳��Ϊ ��
���𰸡�
��1��3Fe+2O2 ![]() Fe3O4
Fe3O4
��2��b
��3���ޣ�Fe+H2SO4=FeSO4+H2��
��4����С
��5��3CO+Fe2O3 ![]() 2Fe+3CO2
2Fe+3CO2
��6��MgSO4 �� ��MgCl2 �� ��Mg��NO3��2��Y��Fe��X
���������⣺��1��A�У���ȼ������������������������Ӧ�Ļ�ѧ����ʽ�ǣ�3Fe+2O2 ![]() Fe3O4 �� ���3Fe+2O2
Fe3O4 �� ���3Fe+2O2 ![]() Fe3O4 �� ��2��B��������������IJ�λ��b����Ϊb������ˮ��������ֽӴ���
Fe3O4 �� ��2��B��������������IJ�λ��b����Ϊb������ˮ��������ֽӴ���
���b����3��C�з�Ӧ�տ�ʼʱ�����ݲ�����һ��ʱ���ϡ���������Ӧ����������������������Ӧ�Ļ�ѧ����ʽΪ��Fe+H2SO4=FeSO4+H2����
����ޣ�Fe+H2SO4=FeSO4+H2������4��D�з�Ӧһ��ʱ����Թ��ڹ��������ȷ�Ӧǰ���ݴ��ƶϣ��Թ�����Һ�����뷴Ӧǰ����Ǽ�С�ģ�
�����С����5����ҵ�ϳ��ó�������Ҫ�ɷ�Ϊ����������һ����̼���·�Ӧ���������䷴Ӧ�Ļ�ѧ����ʽΪ��3CO+Fe2O3 ![]() 2Fe+3CO2 ��
2Fe+3CO2 ��
���3CO+Fe2O3 ![]() 2Fe+3CO2 �� ��6��С��ͬѧΪ̽������ͭ��þ�Ľ������˳����ȡ��Ƭ������ͭ��Һ����һ����Һ��ʵ�飬�����Һ�����ʵĻ�ѧʽΪMgSO4 �� ��MgCl2 �� ��Mg��NO3��2��
2Fe+3CO2 �� ��6��С��ͬѧΪ̽������ͭ��þ�Ľ������˳����ȡ��Ƭ������ͭ��Һ����һ����Һ��ʵ�飬�����Һ�����ʵĻ�ѧʽΪMgSO4 �� ��MgCl2 �� ��Mg��NO3��2��
Сѩͬѧ�ѹ��������ۼ��뵽X��NO3��2��Y��NO3��2�����Һ�г�ַ�Ӧ����ˣ�����ֻ������X��˵��Y�������ã�����X���ã�������X��Y���ֽ��������ǿ������˳��ΪY��Fe��X��
���MgSO4 �� ��MgCl2 �� ��Mg��NO3��2��Y��Fe��X��
�����㾫����������Ҫ�����˽������ϵ�ѡ�����ݺͽ������˳����Ӧ�õ����֪ʶ�㣬��Ҫ���պ�ɫ������ͨ��ָ�����̡��������ǵĺϽ��ؽ�������ͭ��п��Ǧ�ȣ���ɫ��������������ơ�þ�����ȣ���ɫ������ͨ����ָ����ɫ��������������������ڽ������˳���1��������λ��Խ��ǰ�����Ļ�Ծ�Խǿ2��λ����ǰ��Ľ������û������ᡢϡ�����е��⣨������Ũ���ᡢ���ᣩ3��λ��ǰ��Ľ����ܰ�λ�ں���Ľ��������ǵ�����Һ���û�����������K��Ca��Na��������ȷ�����⣮

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�