题目内容
为了测定一瓶新配制的Na2CO3溶液中溶质质量分数,取50gNa2CO3溶液,向其中滴加22.2%的CaCl2溶液,当刚好不再产生沉淀时,停止滴加,过滤,得10g沉淀,试回答下列问题:
(1)写出上述发生反应的化学方程式______;
(2)列出求解Na2CO3质量(x)的比例式______;
(3)Na2CO3溶液中溶质的质量分数为______;
(4)滤液中溶质的质量分数为______.
解:(1)根据碳酸钠与氯化钙反应能生成碳酸钙沉淀和氯化钠,其方程式为Na2CO3+CaCl2═CaCO3↓+2NaCl;
(2)设参加反应的Na2CO3质量为x,氯化钙的质量是y,生成氯化钠的质量是z
CaCl2+Na2CO3=CaCO3↓+2NaCl
111 106 100 117
y x 10g z
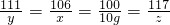
(3)由(2)比例式可知碳酸钠的质量是10.6g,所以 ×100%=21.2%
×100%=21.2%
(4)由(2)比例式可知氯化钙的质量是11.1g,氯化钠的质量是11.7g,所以参与反应的氯化钙溶液质量是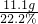 =50g,所以反应后滤液的总质量是50g+50g-10g=90g,则
=50g,所以反应后滤液的总质量是50g+50g-10g=90g,则 ×100%=13%;
×100%=13%;
故答案为:(1)Na2CO3+CaCl2═CaCO3↓+2NaCl;(2) 或
或 ;(3)21.2%;(4)13%;
;(3)21.2%;(4)13%;
分析:(1)根据碳酸钠与氯化钙反应能生成碳酸钙沉淀和氯化钠书写方程式即可;
(2)根据方程式中碳酸钙的质量可以求出碳酸钠的质量,就可得比例式;
(3)根据(2)的比例式求出碳酸钠的质量,进而可求出Na2CO3溶液中溶质的质量分数;
(4)依据方程式也可求出氯化钠的质量,依据质量守恒定律可求出滤液的质量,进而求出滤液中的溶质的质量分数;
点评:此题是一道化学方程式与溶液计算的综合题,解题的难点是分析出反应后溶液的质量等有关问题,充分利用溶液的有关计算以及质量守恒定律是解题的关键;
(2)设参加反应的Na2CO3质量为x,氯化钙的质量是y,生成氯化钠的质量是z
CaCl2+Na2CO3=CaCO3↓+2NaCl
111 106 100 117
y x 10g z
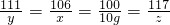
(3)由(2)比例式可知碳酸钠的质量是10.6g,所以
 ×100%=21.2%
×100%=21.2%(4)由(2)比例式可知氯化钙的质量是11.1g,氯化钠的质量是11.7g,所以参与反应的氯化钙溶液质量是
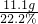 =50g,所以反应后滤液的总质量是50g+50g-10g=90g,则
=50g,所以反应后滤液的总质量是50g+50g-10g=90g,则 ×100%=13%;
×100%=13%;故答案为:(1)Na2CO3+CaCl2═CaCO3↓+2NaCl;(2)
 或
或 ;(3)21.2%;(4)13%;
;(3)21.2%;(4)13%;分析:(1)根据碳酸钠与氯化钙反应能生成碳酸钙沉淀和氯化钠书写方程式即可;
(2)根据方程式中碳酸钙的质量可以求出碳酸钠的质量,就可得比例式;
(3)根据(2)的比例式求出碳酸钠的质量,进而可求出Na2CO3溶液中溶质的质量分数;
(4)依据方程式也可求出氯化钠的质量,依据质量守恒定律可求出滤液的质量,进而求出滤液中的溶质的质量分数;
点评:此题是一道化学方程式与溶液计算的综合题,解题的难点是分析出反应后溶液的质量等有关问题,充分利用溶液的有关计算以及质量守恒定律是解题的关键;

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案
相关题目