题目内容
将氧化铁和碳粉的混合物在密闭容器中充分灼烧,冷却后打开容器,测得容器中气体并无有毒成分,所剩固体物质的质量是原混合物质量的78%,则原混合物中氧元素的质量分数为分析:利用元素守恒的思想和差量法思想来分析解答,一定抓住固体质量减轻的质量就是生成的二氧化碳的质量这一突破口.
解答:解:根据题意所剩固体物质的质量是原混合物质量的78%,则固体质量减轻22%,减轻的质量即为生成的二氧化碳的质量,设原固体混合物质量为1g,则生成的二氧化碳的质量为0.22g,根据碳原子守恒,混合物中单质碳的质量为:0.22g×
×100%=0.06g,故氧化铁的质量为1g-0.06g=0.94g,故原混合物中氧元素的质量=0.94×
×100%=0.282g.故氧元素的质量分数=
×100%=28.2%
故答案为:28.2%.
| 12 |
| 44 |
| 16×3 |
| 160 |
| 0.282g |
| 1g |
故答案为:28.2%.
点评:本题主要考查学生计算能力和解决问题的能力,解决本题的关键是知道固体质量减轻的质量就是生成的二氧化碳的质量.

练习册系列答案
 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
学生研究性学习小组对炭粉与氧化铁反应产物中的气体的成分进行研究:
假设:该反应的气体产物有二氧化碳和其它气体.
设计方案:将一定量氧化铁在隔绝氧气的条件下与过量炭粉完全反应.测定消耗炭和氧元素的质量和生成二氧化碳的质量.
查阅资料:氮气不能跟炭粉和氧化铁发生反应,也不跟碱溶液发生反应,可用来隔绝氧气.
收集证据,验证假设:
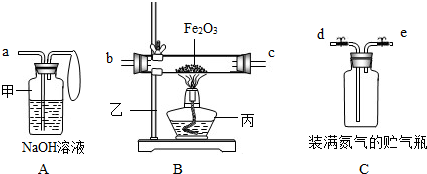
| 操作步骤和实验现象 | 简答 |
| ①取3.2g氧化铁与2g碳粉均匀混合,放入质量为48.2g的B玻璃管中. | 请你写出装置中的仪器名称. 甲________. B玻璃管和氧化铁、碳粉的总质量为________. |
| ②仪器:打开弹簧夹,往贮气瓶中注入水. | 水应往________口注入.(填编号)仪器的连接顺序应是________接________;________接________. |
| ③先通入一段时间纯净、干燥的氮气. | 其目的是:________. |
| ④夹紧弹簧夹后,加热氧化铁. | B玻璃管内的现象是:________. |
| ⑤停止加热,再通入一段时间纯净、干燥的氮气. | 其目的是:________. |
| ⑥实验完毕后,冷却至室温,称B玻璃管和固体总质量为52g,称A瓶连液体增重1.2g. | B玻璃管连固体减少的质量________A瓶连液体增加的质量(填大于、小于或等于). |
| ⑦结论:根据数据处理结果,得出原假设________(填成立或不成立).若假设成立,推测其他气体可能是________. | |
学生研究性学习小组对炭粉与氧化铁反应产物中的气体的成分进行研究:
假设:该反应的气体产物有二氧化碳和其它气体.
设计方案:将一定量氧化铁在隔绝氧气的条件下与过量炭粉完全反应.测定消耗炭和氧元素的质量和生成二氧化碳的质量.
查阅资料:氮气不能跟炭粉和氧化铁发生反应,也不跟碱溶液发生反应,可用来隔绝氧气.
收集证据,验证假设:
假设:该反应的气体产物有二氧化碳和其它气体.
设计方案:将一定量氧化铁在隔绝氧气的条件下与过量炭粉完全反应.测定消耗炭和氧元素的质量和生成二氧化碳的质量.
查阅资料:氮气不能跟炭粉和氧化铁发生反应,也不跟碱溶液发生反应,可用来隔绝氧气.
收集证据,验证假设:

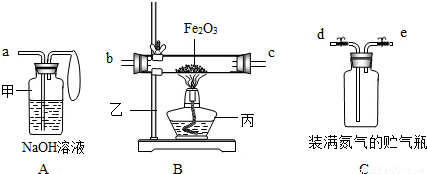
| 操作步骤和实验现象 | 简答 |
| ①取3.2g氧化铁与2g碳粉均匀混合,放入质量为48.2g的B玻璃管中. | 请你写出装置中的仪器名称. 甲________. B玻璃管和氧化铁、碳粉的总质量为________. |
| ②仪器:打开弹簧夹,往贮气瓶中注入水. | 水应往________口注入.(填编号)仪器的连接顺序应是________接________;________接________. |
| ③先通入一段时间纯净、干燥的氮气. | 其目的是:________. |
| ④夹紧弹簧夹后,加热氧化铁. | B玻璃管内的现象是:________. |
| ⑤停止加热,再通入一段时间纯净、干燥的氮气. | 其目的是:________. |
| ⑥实验完毕后,冷却至室温,称B玻璃管和固体总质量为52g,称A瓶连液体增重1.2g. | B玻璃管连固体减少的质量________A瓶连液体增加的质量(填大于、小于或等于). |
| ⑦结论:根据数据处理结果,得出原假设________(填成立或不成立).若假设成立,推测其他气体可能是________. | |
学生研究性学习小组对炭粉与氧化铁反应产物中的气体的成分进行研究:
假设:该反应的气体产物有二氧化碳和其它气体.
设计方案:将一定量氧化铁在隔绝氧气的条件下与过量炭粉完全反应.测定消耗炭和氧元素的质量和生成二氧化碳的质量.
查阅资料:氮气不能跟炭粉和氧化铁发生反应,也不跟碱溶液发生反应,可用来隔绝氧气.
收集证据,验证假设:
假设:该反应的气体产物有二氧化碳和其它气体.
设计方案:将一定量氧化铁在隔绝氧气的条件下与过量炭粉完全反应.测定消耗炭和氧元素的质量和生成二氧化碳的质量.
查阅资料:氮气不能跟炭粉和氧化铁发生反应,也不跟碱溶液发生反应,可用来隔绝氧气.
收集证据,验证假设:

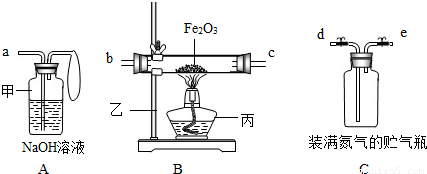
| 操作步骤和实验现象 | 简答 |
| ①取3.2g氧化铁与2g碳粉均匀混合,放入质量为48.2g的B玻璃管中. | 请你写出装置中的仪器名称. 甲________. B玻璃管和氧化铁、碳粉的总质量为________. |
| ②仪器:打开弹簧夹,往贮气瓶中注入水. | 水应往________口注入.(填编号)仪器的连接顺序应是________接________;________接________. |
| ③先通入一段时间纯净、干燥的氮气. | 其目的是:________. |
| ④夹紧弹簧夹后,加热氧化铁. | B玻璃管内的现象是:________. |
| ⑤停止加热,再通入一段时间纯净、干燥的氮气. | 其目的是:________. |
| ⑥实验完毕后,冷却至室温,称B玻璃管和固体总质量为52g,称A瓶连液体增重1.2g. | B玻璃管连固体减少的质量________A瓶连液体增加的质量(填大于、小于或等于). |
| ⑦结论:根据数据处理结果,得出原假设________(填成立或不成立).若假设成立,推测其他气体可能是________. | |
学生研究性学习小组对炭粉与氧化铁反应产物中的气体的成分进行研究:
假设:该反应的气体产物有二氧化碳和其它气体.
设计方案:将一定量氧化铁在隔绝氧气的条件下与过量炭粉完全反应.测定消耗炭和氧元素的质量和生成二氧化碳的质量.
查阅资料:氮气不能跟炭粉和氧化铁发生反应,也不跟碱溶液发生反应,可用来隔绝氧气.
收集证据,验证假设:

假设:该反应的气体产物有二氧化碳和其它气体.
设计方案:将一定量氧化铁在隔绝氧气的条件下与过量炭粉完全反应.测定消耗炭和氧元素的质量和生成二氧化碳的质量.
查阅资料:氮气不能跟炭粉和氧化铁发生反应,也不跟碱溶液发生反应,可用来隔绝氧气.
收集证据,验证假设:

| 操作步骤和实验现象 | 简答 |
| ①取3.2g氧化铁与2g碳粉均匀混合,放入质量为48.2g的B玻璃管中. | 请你写出装置中的仪器名称. 甲________. B玻璃管和氧化铁、碳粉的总质量为________. |
| ②仪器:打开弹簧夹,往贮气瓶中注入水. | 水应往________口注入.(填编号)仪器的连接顺序应是________接________;________接________. |
| ③先通入一段时间纯净、干燥的氮气. | 其目的是:________. |
| ④夹紧弹簧夹后,加热氧化铁. | B玻璃管内的现象是:________. |
| ⑤停止加热,再通入一段时间纯净、干燥的氮气. | 其目的是:________. |
| ⑥实验完毕后,冷却至室温,称B玻璃管和固体总质量为52g,称A瓶连液体增重1.2g. | B玻璃管连固体减少的质量________A瓶连液体增加的质量(填大于、小于或等于). |
| ⑦结论:根据数据处理结果,得出原假设________(填成立或不成立).若假设成立,推测其他气体可能是________. | |
 已知木炭粉和Fe2O3 反应的化学方程式为:2Fe2O3+3C
已知木炭粉和Fe2O3 反应的化学方程式为:2Fe2O3+3C