题目内容
【题目】将一定质量的金属锌投入63.7g稀硫酸中,恰好完全反应,放出气体的质量与反应时间的关系如图所示.试求(计算结果精确到0.1%): 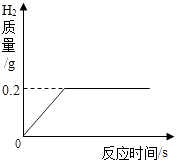
(1)所用硫酸溶液中溶质的质量分数;
(2)反应结束后所得溶液的质量.
【答案】
(1)解:设参加反应锌、硫酸溶液中溶质的质量分别为x、y
Zn+ | H2SO4═ZnSO4+ | H2↑ |
65 | 98 | 2 |
x | y | 0.2g |
![]() =
= ![]() =
= ![]()
x=6.5g
y=9.8g
所用硫酸溶液中溶质的质量分数为: ![]() ×100%=15.4%
×100%=15.4%
答:所用硫酸溶液中溶质的质量分数为15.4%;
(2)解:由质量守恒定律可知,反应结束后所得溶液的质量为:63.7g+6.5g﹣0.2g=70g.
答:反应结束后所得溶液的质量70g.
【解析】题目图中给出了生成的氢气的质量,根据氢气的质量和对应的化学方程式求算所用硫酸中硫酸的质量以及锌的质量.
【考点精析】解答此题的关键在于理解根据化学反应方程式的计算的相关知识,掌握各物质间质量比=系数×相对分子质量之比.

练习册系列答案
相关题目