题目内容
实验室中取氯酸钾和二氧化锰的混合物15.5克,加热制取氧气.待充分反应后,冷却,称得固体残渣的质量为10.7克.为了节约药品,将固体残渣放入55克蒸馏水中,充分溶解后过滤,回收二氧化锰和滤液.计算:
(1)回收得到二氧化锰的质量.
(2)滤液中溶质的质量分数(结果精确到0.01).
解:由题意知,生成氧气的质量为15.5g-10.7g=4.8g
设反应中生成KCl的质量为x.
2KClO3 2KCl+3O2↑
2KCl+3O2↑
2×74.5 3×32
x 4.8g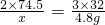 x=7.45g
x=7.45g
MnO2的质量为:10.7g-7.45g=3.25g
KCl溶液中溶质的质量分数为: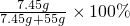 =12%
=12%
答:回收得到MnO2的质量为3.25克,滤液中溶质的质量分数为12%
故答案为:(1)3.25g (2)12%
分析:根据化学方程式计算的步骤有:一设、二写、三找、四列、五答、六查.在本题中,反应前后固体出现了差值,根据质量守恒定律,减少的质量是氧气的质量.根据氧气的质量求氯化钾的质量,固体残渣是氯化钾和二氧化锰的混合物,因此用10.7克减去氯化钾的质量就等于二氧化锰的质量.再根据溶质的质量分数公式求氯化钾的质量分数.
点评:本考点考查了根据化学方程式的计算,属于质量分数和化学方程式的综合应用,是中考计算题中经常出现的题型.做题时要注意:化学方程式要写正确,始终不要忘记质量守恒定律,还要记牢“遇到差值要想气体”.本考点主要出现在计算题中.
设反应中生成KCl的质量为x.
2KClO3
 2KCl+3O2↑
2KCl+3O2↑2×74.5 3×32
x 4.8g
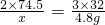 x=7.45g
x=7.45gMnO2的质量为:10.7g-7.45g=3.25g
KCl溶液中溶质的质量分数为:
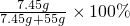 =12%
=12%答:回收得到MnO2的质量为3.25克,滤液中溶质的质量分数为12%
故答案为:(1)3.25g (2)12%
分析:根据化学方程式计算的步骤有:一设、二写、三找、四列、五答、六查.在本题中,反应前后固体出现了差值,根据质量守恒定律,减少的质量是氧气的质量.根据氧气的质量求氯化钾的质量,固体残渣是氯化钾和二氧化锰的混合物,因此用10.7克减去氯化钾的质量就等于二氧化锰的质量.再根据溶质的质量分数公式求氯化钾的质量分数.
点评:本考点考查了根据化学方程式的计算,属于质量分数和化学方程式的综合应用,是中考计算题中经常出现的题型.做题时要注意:化学方程式要写正确,始终不要忘记质量守恒定律,还要记牢“遇到差值要想气体”.本考点主要出现在计算题中.

练习册系列答案
相关题目