题目内容
【题目】如图是氢氧化钠溶液和盐酸用滴加方式反应时,溶液pH随滴入溶液体积变化的曲线。
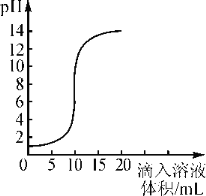
(1)氢氧化钠和盐酸恰好完全反应时,溶液的pH 7(选填“大于”、“小于”或“等于”);
(2)根据曲线判断,该反应是将 (选填“氢氧化钠溶液”或“盐酸”)滴入另一种溶液中,理由是 ;
(3)当滴入溶液的体积为5mL时,所得溶液中溶质的化学式为 ;
(4)欲中和20g溶质的质量分数为10%的氢氧化钠溶液,需溶质质量分数为x18.25%的稀盐酸 g。
【答案】⑴ 等于 ⑵氢氧化钠 溶液的pH逐渐变大⑶HCl和NaCl ⑷10
【解析】
试题分析:⑴氢氧化钠和盐酸恰好完全反应时,溶液中只有氯化钠和水,溶液呈中性,pH等于7,⑵由于曲线的起点溶液的pH小于7说明开始溶液为酸,然后随液体的加入氢氧化钠溶液的pH逐渐变大,最后呈碱性,溶液的pH逐渐变大大于7,可知实验是将氢氧化钠溶液加入盐酸中⑶当滴入溶液的体积为5mL时,溶液显酸性,说明所得溶液中溶质为生成的氯化钠和剩余的氯化氢,⑷设需溶质质量分数为18.25%的稀盐酸的质量为x,
NaOH+HCl=NaCl+H20
40 36.5
20g×10% x×18.25%
40/(20g×10%)= 36.5/( x×18.25%)得x=10g

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目