题目内容
【题目】漳州小吃手抓面,制作时要用到大树碱,大树碱的主要成分是K2CO3。为了测定大树碱中K2CO3的质量分数,小文同学进行了如下实验;
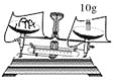
(1)用托盘天平称取10g大树碱样品,在称量过程中发现天平指针如图所示,则此时应进行的操作是________________________________________________________________________。
(2)用量筒量取一定量的水,为了准确量取水的体积,还需要使用的仪器是____________。
(3)把大树碱样品和水加入烧杯中,用玻璃棒搅拌,使大树碱完全溶解,玻璃棒的作用是___________________。
(4)向配好的溶液中逐渐加入CaCl2溶液,生成1g沉淀(假设大树碱中其他成分不参与反应,反应的化学方程式为CaCl2+K2CO3=CaCO3↓+2KCl)。计算大树碱中K2CO3的质量分数。________________________。
(5)小文同学在配制好溶液后,发现纸片上还有残留固体,则计算出的大树碱K2CO3的质量分数________(填“偏大”或“偏小”)。
【答案】往左盘加树碱至天平平衡 胶头滴管 搅拌,加速溶解 13.8% 偏小
【解析】
(1)指针偏右,说明左盘树碱样品小于10g,则此时应进行的操作是往左盘加树碱,至天平平衡;
(2用量筒量取一定量的水时,可将量筒倾斜,用倾倒的方法把水倒入,边倒边看液面与刻度线,当液面接近所需刻度线时,应将量筒放平,换用胶头滴管向里滴加,边滴边看,直到量筒内水的凹液面的最低处与所需刻度线保持水平为止。用量筒量取一定量的水,为了准确量取水的体积,还需要使用的仪器是胶头滴管;
(3)溶解中玻璃棒的作用是搅拌,加速溶解;
(4)设碳酸钾的质量为x。
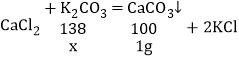
![]() x=1.38g;
x=1.38g;
大树碱中K2CO3的质量分数=![]() ;
;
(5)纸片上还有残留固体,则溶液中溶质偏小,质量分数偏小。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】多彩的“碳”,多姿的生活,让我们一起走进“碳”的世界.
(1)根据下表提供的信息,填写有关含碳物质的对应性质.
物质用途 | 金刚石切割玻璃 | 石墨作电极 | 活性炭净水 |
对应性质 | ①________ | ②_______ | ③_______ |
(2)液态二氧化碳灭火器可用于扑救档案资料室发生的火灾,下列说法正确的有______(填标号).
A.液态二氧化碳气化后不会污染档案资料
B.二氧化碳可覆盖在燃烧物表面,隔绝空气
C.液态二氧化碳气化时吸热,降低了可燃物的着火点.
(3)“低碳生活”倡导低能量,低消耗,主要是为了减少___ (填化学式)的持放量。
(4)汽车的燃料主要是汽油,汽油的成分复杂,本题用C8H10代表。则汽油完全燃烧的化学方程式_____。