题目内容
取10g CO和CO2的混合气体,缓慢通过过量的石灰水,充分反应后,过滤得干燥的固体10g.求:(1)原混合气体中CO2的质量.
(2)原混合物气体中C0和CO2所含碳原子个数比.
【答案】分析:混合气体中二氧化碳可与石灰水反应生成碳酸钙沉淀,而一氧化碳不反应,根据生成固体的质量结合二氧化碳与石灰水反应的方程式可以计算出二氧化碳的质量,从而计算出混合气体中一氧化碳的质量,原混合物气体中C0和CO2所含碳原子个数比等于一氧化碳和二氧化碳气体中碳元素的质量比.
解答:解:(1)石灰水是过量的,所以二氧化碳完全反应.
设原混合气体中含CO2为x
CO2+Ca(OH)2═CaCO3↓+H2O
44 100
X 10g
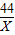 =
=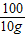
X=4.4 g
(2)原混合气体中C0的质量:lOg-4.4g=5.6g
则 4.4 g CO2中含碳元素的质量为4.4g×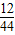 ×100%=12g
×100%=12g
5.6 g CO中含碳元素的质量为 5.6g×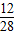 ×100%=2.4 g
×100%=2.4 g
所以原混合物中CO和CO2所含碳原子个数比为 2.4:1.2=2:1
答:原混合气体中CO2的质量是4.4g,C0和CO2所含碳原子个数比是2:1.
点评:本题主要考查化学方程式的书写和有关化学方程式的计算,难度较小,同时明确原混合物气体中C0和CO2所含碳原子个数比等于一氧化碳和二氧化碳气体中碳元素的质量比..
解答:解:(1)石灰水是过量的,所以二氧化碳完全反应.
设原混合气体中含CO2为x
CO2+Ca(OH)2═CaCO3↓+H2O
44 100
X 10g
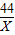 =
=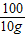
X=4.4 g
(2)原混合气体中C0的质量:lOg-4.4g=5.6g
则 4.4 g CO2中含碳元素的质量为4.4g×
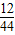 ×100%=12g
×100%=12g5.6 g CO中含碳元素的质量为 5.6g×
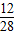 ×100%=2.4 g
×100%=2.4 g所以原混合物中CO和CO2所含碳原子个数比为 2.4:1.2=2:1
答:原混合气体中CO2的质量是4.4g,C0和CO2所含碳原子个数比是2:1.
点评:本题主要考查化学方程式的书写和有关化学方程式的计算,难度较小,同时明确原混合物气体中C0和CO2所含碳原子个数比等于一氧化碳和二氧化碳气体中碳元素的质量比..

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目