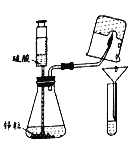题目内容
【题目】人们曾用贝壳(主要成分是碳酸钙,杂质不参与反应且不溶于水)和纯碱为原材料制取烧碱,制取流程如下图所示。

(1)写出步骤①和步骤③中发生反应的化学方程式______________________________、______________________________。
(2)固体A的成分可能是纯净的氢氧化钠,还可能是__________________________________。
(3)证明固体A是纯净的氢氧化钠的实验方案是______________________________________。
【答案】 CaCO3高温CaO+CO2↑ Ca(OH)2+Na2CO3 === CaCO3↓+2NaOH NaOH和Na2CO3、NaOH和Ca(OH)2 分别取固体A于两支试管中,加水溶解,一支试管中加入氢氧化钙溶液,另一支试管中加入碳酸钠溶液,均无明显现象,则固体A为纯净的氢氧化钠(合理给分)
【解析】(1). 碳酸钙在高温下分解生成二氧化碳和氧化钙,方程式为:CaCO3高温CaO+CO2↑ (2). 氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠:Ca(OH)2+Na2CO3 === CaCO3↓+2NaOH (3). 氢氧化钙和碳酸钠反应后,生成物氢氧化钠一定存在,还可能有过量的反应物,所以溶质可能是氢氧化钠或NaOH和Na2CO3、NaOH和Ca(OH)2 ;所得固体中除氢氧化钠外还可能有氢氧化钙或碳酸钠(4). 证明固体A是纯净的氢氧化钠的实验方案是分别取固体A于两支试管中,加水溶解,一支试管中加入氢氧化钙溶液,另一支试管中加入碳酸钠溶液,均无明显现象,则固体A为纯净的氢氧化钠(合理给分)

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目