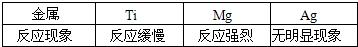
题目内容
将炉甘石(主要成分为ZnCO3)、赤铜矿(主要成分是Cu2O)和木炭混合加热到800℃左右,可冶炼出一种外观与通常所说的金子很相似的物质,该物质被称为“药金”.(1)试分析药金中
(2)小明将药金进行高温加热,发现药金变为黑色,据此,小明认为药金中含有铜.试写出该反应的化学方程式.
(3)小明为了证明药金是否含有锌:取药金少量于试管中,加入盐酸进行浸泡,发现有气泡产生,用实验验证,该气体为
分析:(1)任何化学变化都遵循质量守恒定律,变化前后元素的种类不变;
(2)铜在加热条件下能与空气中氧气反应生成黑色的氧化铜;
(3)根据金属活动性可知,锌能与稀盐酸反应放出氢气,因此,只需证明放入稀盐酸的药金反应放出的气体为氢气,就可以证明药金中含能与稀盐酸反应的锌.
(2)铜在加热条件下能与空气中氧气反应生成黑色的氧化铜;
(3)根据金属活动性可知,锌能与稀盐酸反应放出氢气,因此,只需证明放入稀盐酸的药金反应放出的气体为氢气,就可以证明药金中含能与稀盐酸反应的锌.
解答:解:(1)根据质量守恒定律,反应前后元素的种类不变,反应前炉甘石中不含元素Au,所以反应后的生成物“药金”中也一定不含有元素Au;
故答案为:无;
(2)加热条件下,铜与氧气化合生成黑色的氧化铜;
故答案为:2Cu+O2
2CuO;
(3)铜不能与稀盐酸反应而锌可与稀盐酸反应放出氢气,因此证明反应后放出了氢气即可证明药金中含有锌;锌与盐酸发生置换反应,生成氯化锌和氢气;
故答案为:H2;Zn+2HCl=ZnCl2+H2↑.
故答案为:无;
(2)加热条件下,铜与氧气化合生成黑色的氧化铜;
故答案为:2Cu+O2
| ||
(3)铜不能与稀盐酸反应而锌可与稀盐酸反应放出氢气,因此证明反应后放出了氢气即可证明药金中含有锌;锌与盐酸发生置换反应,生成氯化锌和氢气;
故答案为:H2;Zn+2HCl=ZnCl2+H2↑.
点评:根据质量守恒定律,反应前后元素的种类不变,可由反应物或生成物的组成元素推断生成物或反应物的组成.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目