题目内容
(10日照29)某兴趣小组需要10%的氢氧化钠溶液和10%的硫酸溶液,进行中和反应实验。
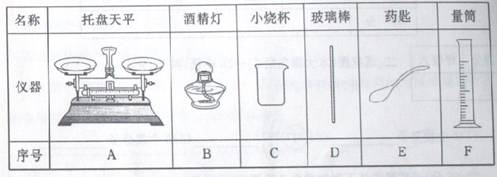
(1)若选择40g上述氢氧化钠溶液,则需要氢氧化钠固体的质量为_______g。从下表中选择称量氢氧化钠固体所需要的仪器______.(填序号)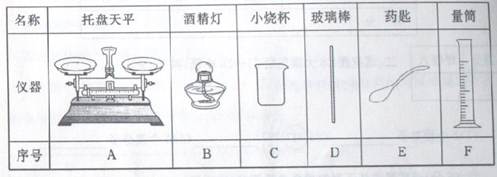
(2)为中和上述氢氧化钠溶液,需10%的硫酸溶液的质量为____g;计算反应后所得溶液的溶质质量分数是多少?(精确到1%)
(1)4 A C E (2)49 8%
解析试题分析:(1)配制40g溶质质量分数为10%的氢氧化钠溶液,需要氢氧化钠的质量=40g×10%=4g,氢氧化钠的强烈腐蚀性要求在称量氢氧化钠时就放在玻璃器皿内,因此称量氢氧化钠时应选用托盘天平、烧杯、药匙三种仪器,
(2)设需10%的硫酸溶液的质量为x,反应生成硫酸钠的质量为y,
2NaOH+H2SO4═Na2SO4+2H2O
80 98 142
4g x?10% y
80/98="4g/" x?10% x=49g,
80/142=4g/y y=7.1g,
反应后所得溶液的溶质质量分数="7.1g/(" 40g+49g) ×100%=7.98%≈8%。
考点:此题考查的是一定溶质质量分数的溶液的配制,常用仪器的名称和选用,有关溶质质量分数的简单计算,中和反应及其应用,根据化学反应方程式的计算。
点评:根据质量守恒定律,氢氧化钠溶液与稀硫酸反应既无气体也无沉淀产生,因此反应后所得溶液即为氢氧化钠溶液与稀硫酸的质量和.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案
相关题目