题目内容
【题目】根据表中NaCl和KNO3溶解度数据,回答下列问题。
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
NaCl溶解度(g/100g水) | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
KNO3溶解度(g/100g水) | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
①40℃时,NaCl的溶解度是 (7) 。
②20℃时,将等质量KNO3和NaCl固体,分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1,加热到60℃时现象如图2(不考虑水分蒸发)。
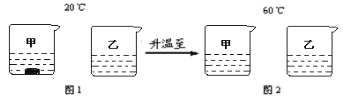
根据图1和图2现象判断:甲烧杯中的固体是 (8) ;将图2中的两溶液降温至40℃时,对两种溶液的分析正确的是 (9) 。
A.甲一定是饱和溶液
B.两溶液中溶质质量分数一定相等
C.乙一定是不饱和溶液
D.甲一定会析出晶体
E.甲溶液浓度一定大于乙溶液浓度
③如果60℃时KNO3饱和溶液中混有少量NaCl时,提纯KNO3可采用方法 (10) 。
④将等质量KNO3的饱和溶液和NaCl的饱和溶液从60℃降温到20℃后,所得溶液中溶质质量分数大的是 (11) 溶液。
【答案】(7)36.0g
(8)KNO3
(9)B C (2分)
(10)冷却结晶
(11)NaCl
【解析】
试题分析:(7)根据表格中数据可知,40℃时,NaCl的溶解度是36.0g;
(8)20℃时氯化钠溶解度大于硝酸钾溶解度,则甲烧杯中的固体为硝酸钾;
(9)A、甲物质硝酸钾溶解度随温度升高而增大,从60℃降温到40℃时,不知最开始时硝酸钾质量,则此时可能是饱和溶液,也可能是不饱和溶液,错误;B、20℃时,将等质量KNO3和NaCl固体,分别加入到盛有100g水的烧杯中,甲物质形成溶液为饱和溶液,而乙物质形成溶液为不饱和溶液,根据表格中数据可知,硝酸钾和氯化钠质量X为:31.6g<X<36g,则将图2中的两溶液降温至40℃时,两溶液均为不饱和溶液,则此时两溶液中溶质质量分数一定相等,正确;C、根据硝酸钾和氯化钠质量X为:31.6g<X<36g,则降温至40℃时,乙溶液一定为不饱和溶液,正确;D、降温至40℃时,乙物质溶解度为63.9g,而乙物质质量X为:31.6g<X<36g,则甲不会有晶体析出,错误;E、由B可知,甲和乙浓度相等,错误。故选BC
(10)硝酸钾溶解度随温度升高而增大,则提纯硝酸钾可以用降温结晶的方法;
(11)将等质量KNO3的饱和溶液和NaCl的饱和溶液从60℃降温到20℃后,两溶液仍为饱和溶液,而20℃时,氯化钠溶解度大于硝酸钾溶解度,所以此时氯化钠溶液中溶质质量分数大于硝酸钾溶液溶质质量分数。


