题目内容
(2013?福建)将质量为44.4克含有少量NaCl的纯碱晶体(Na2CO3?nH2O)样品,平均分成A、B、C三份,进行如图实验(Na2CO3受热不分解).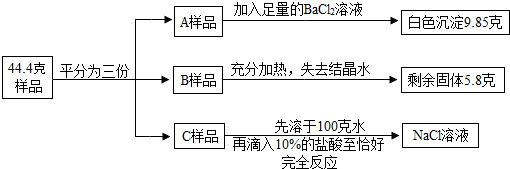
(1)将A样品与BaCl2溶液反应生成的白色沉淀分离出来的方法是
(2)A样品中与BaCl2溶液反应的Na2CO3的质量是
(3)B样品中含有结晶水的质量是
(4)化学式Na2CO3?nH2O中n是多少?
(5)对C样品的操作结束后,所得NaCl溶液的溶质质量分数是多少?(精确到0.01%)

(1)将A样品与BaCl2溶液反应生成的白色沉淀分离出来的方法是
过滤
过滤
.(2)A样品中与BaCl2溶液反应的Na2CO3的质量是
5.3
5.3
克.(3)B样品中含有结晶水的质量是
9
9
克.(4)化学式Na2CO3?nH2O中n是多少?
(5)对C样品的操作结束后,所得NaCl溶液的溶质质量分数是多少?(精确到0.01%)
分析:(1)根据过滤用于分离难溶于水的物质和可溶于水的物质进行解答;
(2)根据白色沉淀就是碳酸钡的质量求出碳酸钠质量即可;
(3)根据B样品的质量减去剩余固体的质量即为结晶水的质量即可;
(4)根据碳酸钠的质量和结晶水的质量求出化学式Na2CO3?nH2O中n即可;
(5)根据碳酸钠的质量求出氯化钠的质量进而求出所得NaCl溶液的溶质质量分数即可.
(2)根据白色沉淀就是碳酸钡的质量求出碳酸钠质量即可;
(3)根据B样品的质量减去剩余固体的质量即为结晶水的质量即可;
(4)根据碳酸钠的质量和结晶水的质量求出化学式Na2CO3?nH2O中n即可;
(5)根据碳酸钠的质量求出氯化钠的质量进而求出所得NaCl溶液的溶质质量分数即可.
解答:解:(1)过滤用于分离难溶于水的物质和可溶于水的物质,所以将A样品与BaCl2溶液反应生成的白色沉淀分离出来的方法是过滤;故填:过滤;
(2)设样品中碳酸钠的质量是x
BaCl2+Na2CO3═BaCO3↓+2NaCl
106 197
x 9.85g
=
x=5.3g
答:A样品中与BaCl2溶液反应的Na2CO3的质量是5.3g.
(3)根据B样品的质量减去剩余固体的质量即为结晶水的质量,结晶水的质量=
-5.8g=9g;故填:9;
(4)由于B样品中Na2CO3的质量与A相等,也为5.3克,结晶水的质量为9克,所以碳酸钠与结晶水的质量比:106:(18×n)=5.3:9解得n=10;故填:10;
(5)设盐酸溶液的质量为x,生成氯化钠的质量为y,生成二氧化碳的质量为z.
由于B样品中Na2CO3的质量与C相等,也为5.3g
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 117 44
5.3g 10%×x y z
=
x=36.5g
=
y=5.85g
=
z=2.2g
氯化钠溶液的质量为:14.8g+100g+36.5g-2.2g=149.1g
溶质氯化钠的质量为:5.85g+14.8g-5.3g-9g=6.35g
氯化钠溶液中溶质的质量分数=
×100%=4.26%
答:溶质的质量分数为4.26%.
(2)设样品中碳酸钠的质量是x
BaCl2+Na2CO3═BaCO3↓+2NaCl
106 197
x 9.85g
| 106 |
| x |
| 197 |
| 9.85g |
x=5.3g
答:A样品中与BaCl2溶液反应的Na2CO3的质量是5.3g.
(3)根据B样品的质量减去剩余固体的质量即为结晶水的质量,结晶水的质量=
| 44.4g |
| 3 |
(4)由于B样品中Na2CO3的质量与A相等,也为5.3克,结晶水的质量为9克,所以碳酸钠与结晶水的质量比:106:(18×n)=5.3:9解得n=10;故填:10;
(5)设盐酸溶液的质量为x,生成氯化钠的质量为y,生成二氧化碳的质量为z.
由于B样品中Na2CO3的质量与C相等,也为5.3g
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 117 44
5.3g 10%×x y z
| 106 |
| 5.3g |
| 73 |
| 10%×x |
x=36.5g
| 106 |
| 5.3g |
| 117 |
| y |
y=5.85g
| 106 |
| 5.3g |
| 44 |
| z |
z=2.2g
氯化钠溶液的质量为:14.8g+100g+36.5g-2.2g=149.1g
溶质氯化钠的质量为:5.85g+14.8g-5.3g-9g=6.35g
氯化钠溶液中溶质的质量分数=
| 6.35g |
| 149.1g |
答:溶质的质量分数为4.26%.
点评:本题充分考查利用课本知识解决新问题能力,能加深学生对课本知识的理解,训练学生的思维能力、分析解决问题的能力,难度稍大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
