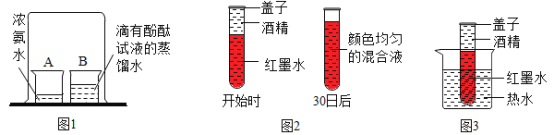
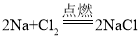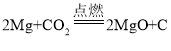题目内容
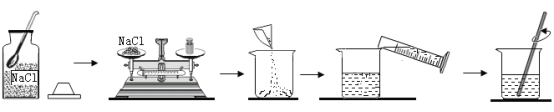
【题目】黄铜渣中约含锌7%、氧化锌31%、铜50%、氧化铜53%,其余为杂质,处理黄铜渣可得到硫酸锌,其主要流程如下(杂质不溶于水也不参与反应)
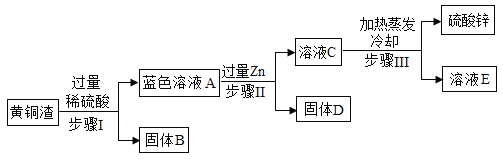
(1)溶液A中的阳离子有_____(填离子符号)。
(2)步骤Ⅱ中溶液由蓝色变为无色的化学反应方程式为_____。
(3)溶液A_____(填“大于”、“小于”或“等于”)溶液C质量。
【答案】H+、Zn2+、Cu2+ ![]() 小于
小于
【解析】
用黄铜渣中约含锌7%、氧化锌31%、铜50%、氧化铜53%来制取硫酸锌,流程是用硫酸把锌、氧化锌和氧化铜固体溶解,再用锌把溶液中的硫酸铜除去。
(1)黄铜渣加入过量的稀硫酸得到溶液A,锌、氧化锌分别与硫酸反应生成硫酸锌,氧化铜与硫酸反应生成硫酸铜,那么溶液A中含有硫酸铜、硫酸锌和过量的硫酸,它们含有的阳离子有H+、Zn2+、Cu2+。
(2)步骤Ⅱ中溶液由蓝色变为无色,是因为锌与硫酸铜反应,把硫酸铜中的铜置换出来,化学反应方程式为:![]() 。
。
(3)溶液A加入锌后变为溶液C,溶液改变的量是硫酸铜变为硫酸锌和硫酸变为硫酸锌。硫酸锌的相对分子质量大于硫酸铜或硫酸的相对分子质量,所以反应后溶液质量增大,故溶液A小于溶液C质量。

练习册系列答案
相关题目
【题目】硝酸钾在不同温度下的溶解度如下表。下列说法不正确的是
温度/°C | 10 | 20 | 30 | 60 | 80 | 100 |
溶解度/g | 20.9 | 31.6 | 45.8 | 110 | 169 | 246 |
A.KNO3的溶解度随温度升高而增大
B.80°C 的KNO3饱和溶液降温至20°C有晶体析出
C.20°C时,KNO3饱和溶液中溶质质量分数为31. 6%
D.把20°C时的KNO3饱和溶液升温至60°C,溶液的溶质质量分数不变