题目内容
【题目】Ⅰ、黄铜是铜和锌的合金,某化学兴趣小组为研究合金中的铜的含量,取样品15g进行如下操作。
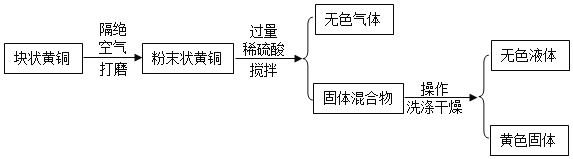
(1)操作①的名称是______。该操作用到的玻璃仪器有玻璃棒、烧杯、_______。
(2)加入稀硫酸发生的反应的化学方程式为_________。
(3)最后称得黄色固体为13g,得到含铜量为86.7%,高于实际含铜量,其原因可能是_______。
【答案】过滤 漏斗 ![]() 由于铜覆盖在锌的表面,使锌不能完全反应
由于铜覆盖在锌的表面,使锌不能完全反应
【解析】
(1)操作①能将固、液分开,名称是过滤,该操作用到的玻璃仪器有玻璃棒、烧杯、漏斗;
(2)加入稀硫酸发生的反应的是锌与稀硫酸反应生成了硫酸锌和氢气,化学方程式为:Zn+H2SO4═ZnSO4+H2↑;
(3)最后称得黄色固体为13g,得到含铜量为86.7%,高于实际含铜量,其原因可能是:由于铜覆盖在锌的表面,使锌不能完全反应等。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
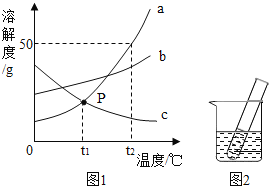
【题目】下表是NaCl和Na2CO3在不同温度下的溶解度,下列说法中不正确的是( )
温度/℃ | 0 | 10 | 20 | 30 | 40 | |
溶解度/g | NaCl | 35.0 | 35.5 | 36.0 | 36.5 | 37.0 |
Na2CO3 | 6.0 | 10.0 | 18.0 | 36.5 | 50.0 | |
A. 两种物质溶解度相等的温度在30℃
B. 生活在盐碱湖附近的人们习惯“夏天晒盐、冬天捞碱”
C. 40℃时,5gNaCl中加10g水可得溶质质量分数为26.3%的溶液
D. 40℃时,9g Na2CO3中加20g水,充分溶解后再降温到10℃,析出固体的质量为7g