题目内容
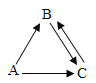
【题目】将5%的NaOH溶液逐滴加入到10g稀盐酸中,边加边搅拌,随着NaOH溶液的加入,溶液pH的变化如图所示。试回答:

(1)b点溶液中存在的溶质有_____(填化学式);
(2)当恰好完全反应时,消耗NaOH溶液的质量为_____:
(3)a点所得溶液中溶质的质量分数_____(写出计算过程)。
【答案】NaCl和NaOH 16g 4.5%
【解析】
氢氧化钠与盐酸反应生成氯化钠和水。
(1)b点溶液中pH值大于7,故溶液中存在的溶质有NaCl和NaOH;
(2)a点的pH值为7,说明这时恰好反应,消耗氢氧化钠溶液的质量为16g;
(3)设a点所得溶液中溶质的质量为x
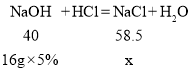
![]()
x=1.17g
a点所得溶液中溶质的质量分数:![]()
答:a点所得溶液中溶质的质量分数为4.5%。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】下表是“部分酸、碱和盐的溶解性表(室温)”中的一部分,下列与“★”处有关的说法正确的是( )
阳离子 | 阴离子 | ||
… | … | NO | Cl- |
… | … | … | … |
Cu2+ | … | ★ | 溶 |
Ag+ | … | 溶 | 不 |
A. ★处对应物质的化学式是CuNO3 B. ★处对应物质属于盐
C. ★处应填“不” D. ★处对应物质的名称是氯化铜
【题目】实验室用碳酸钠溶液与氯化钙溶液反应制取高纯度碳酸钙粉末,烧杯中现有80g碳酸钠溶液。将90g氯化钙溶液分四次加入,充分反应,四次测量所得数据如下表所示:
次数 | 一 | 二 | 三 | 四 |
加入氯化钙溶液的质量/g | 20 | 20 | 20 | 30 |
烧杯中溶液的总质量/g | 97 | 114 | 131 | 160 |
(1)恰好完全反应时,生成沉淀的总质量为_____g。
(2)第三次测量时,所得溶液中的溶质有_____(填化学式)。
(3)计算氯化钙溶液的溶质质量分数_____(写出计算过程)。