题目内容
学生在实验室配制溶液时,常涉及以下过程:
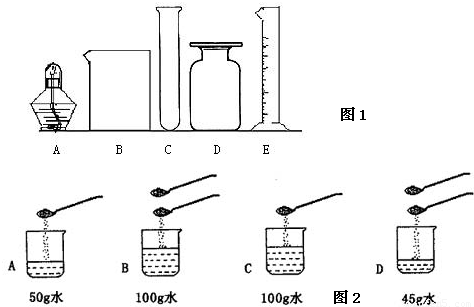
(1)图1所指仪器的名称是:B
请按要求回答下列问题:
(2)九(5)同学用氯化钠和蒸馏水配制50g 5%的氯化钠溶液,正确的操作顺序是
(3)九(4)同学用含杂质10%的食盐固体(杂质不溶于水)和蒸馏水配制50g 5%的氯化钠溶液,正确的操作顺序是
(4)玻璃棒在该实验的作用是
(5)如图2所示:在A、B、C. D四个烧杯的水中加入食盐(每勺食盐质量均为5g),待食盐完全溶解后,所得溶液中溶质的质量分数相等的是
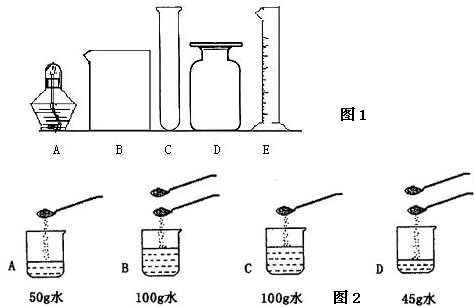
(1)图1所指仪器的名称是:B
烧杯
烧杯
E量筒
量筒
①称量、量取;②过滤;③蒸发结晶、干燥;④计算;⑤溶解请按要求回答下列问题:
(2)九(5)同学用氯化钠和蒸馏水配制50g 5%的氯化钠溶液,正确的操作顺序是
④①⑤
④①⑤
(用以上序号填空).现实验室中有10ml、80ml、100ml等不同规格的量筒,量取蒸馏水的体积是47.5
47.5
ml,配制上述溶液时最好选用80
80
ml的量筒.(3)九(4)同学用含杂质10%的食盐固体(杂质不溶于水)和蒸馏水配制50g 5%的氯化钠溶液,正确的操作顺序是
④⑤②③①⑤
④⑤②③①⑤
.(用以上序号填空)(4)玻璃棒在该实验的作用是
加快溶解
加快溶解
.在过滤时的作用是引流液体
引流液体
.(5)如图2所示:在A、B、C. D四个烧杯的水中加入食盐(每勺食盐质量均为5g),待食盐完全溶解后,所得溶液中溶质的质量分数相等的是
A
A
与B
B
(填序号,下同),溶质的质量分数之比为2:1的是D
D
与A或B
A或B
.
分析:(1)运用常见仪器的名称分析.
(2)运用用食盐配制溶液的基本步骤:计算、称量、溶解分析解答.
(3)用含杂质的食盐固体配制时先要得到纯净的食盐固体再根据计算的数据称量和量取,然后溶解;量筒的选择选择一次能量取并且最接近的量筒分析.
(4)运用溶解时玻璃棒的作用是加快溶解,过滤时玻璃棒的作用是引流液体分析.
(5)根据溶液中溶质质量分数=
×100%分析.
(2)运用用食盐配制溶液的基本步骤:计算、称量、溶解分析解答.
(3)用含杂质的食盐固体配制时先要得到纯净的食盐固体再根据计算的数据称量和量取,然后溶解;量筒的选择选择一次能量取并且最接近的量筒分析.
(4)运用溶解时玻璃棒的作用是加快溶解,过滤时玻璃棒的作用是引流液体分析.
(5)根据溶液中溶质质量分数=
| 溶质质量 |
| 溶液质量 |
解答:解:(1)从图中可以看出B是烧杯、E是量筒,故答案:烧杯 量筒.
(2)配制溶液的基本步骤:计算、称量、溶解;配制50g溶质质量分数为5%的氯化钠溶液50g×5%=2.5g,需要水50g-2.5g=47.5g(合47.5mL);量筒的选择选择一次能量取并且最接近的量筒,所以选择80mL的量筒即可.故答案:④①⑤;47.5;80.
(3)用含杂质10%的食盐固体(杂质不溶于水)和蒸馏水配制50g 5%的氯化钠溶液,要先将含杂质的食盐配制要先将食盐溶解过滤除去杂质蒸馏得到干燥的纯净的食盐;然后根据计算配制50g溶质质量分数为5%的氯化钠溶液50g×5%=2.5g,需要水50g-2.5g=47.5g(合47.5mL)称取和量取,最后溶解即可得到.故答案:④⑤②③①⑤.
(4)溶解时玻璃棒的作用是加快溶解,过滤时玻璃棒的作用是引流液体,故答案:加快溶解;引流液体.
(5)A中所得溶液溶质质量分数为:
×100%=
;B中所的溶液溶质质量分数=
×100%=
;C中所得的溶液溶质质量分数为
×100%=
;D中所得溶液溶质质量分数为:
×100%=
;故答案:A与B;D与A或B.
(2)配制溶液的基本步骤:计算、称量、溶解;配制50g溶质质量分数为5%的氯化钠溶液50g×5%=2.5g,需要水50g-2.5g=47.5g(合47.5mL);量筒的选择选择一次能量取并且最接近的量筒,所以选择80mL的量筒即可.故答案:④①⑤;47.5;80.
(3)用含杂质10%的食盐固体(杂质不溶于水)和蒸馏水配制50g 5%的氯化钠溶液,要先将含杂质的食盐配制要先将食盐溶解过滤除去杂质蒸馏得到干燥的纯净的食盐;然后根据计算配制50g溶质质量分数为5%的氯化钠溶液50g×5%=2.5g,需要水50g-2.5g=47.5g(合47.5mL)称取和量取,最后溶解即可得到.故答案:④⑤②③①⑤.
(4)溶解时玻璃棒的作用是加快溶解,过滤时玻璃棒的作用是引流液体,故答案:加快溶解;引流液体.
(5)A中所得溶液溶质质量分数为:
| 5g |
| 55g |
| 1 |
| 11 |
| 10g |
| 110g |
| 1 |
| 11 |
| 5g |
| 105g |
| 1 |
| 21 |
| 10g |
| 55g |
| 2 |
| 11 |
点评:配制溶液两种常见操作:固体溶质加水溶解,配制步骤计算-称量-溶解;液体加水稀释,配制步骤计算-量取-溶解.一般固体溶质含不溶性杂质的话要先溶解除去杂质再称量量取溶解.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
 同时进行了酸碱度的测定并表示于数轴上.其中能表示盐酸的pH的点是( )
同时进行了酸碱度的测定并表示于数轴上.其中能表示盐酸的pH的点是( )