题目内容
(2013?广州)化学反应有不同的分类方法,关于下列反应说法正确的是( )
①2H2O
2H2↑+O2↑
②8Al+3Fe3O4
4Al2O3+9Fe
③CH4+2O2
CO2+2H2O.
①2H2O
| ||
②8Al+3Fe3O4
| ||
③CH4+2O2
| ||
分析:根据反应物和生成物的种类可以判断反应类型,可燃物燃烧时放出热量.
解答:解:A、由2H2O
2H2↑+O2↑可知,反应物是一种,生成物是两种,属于分解反应.错误.
B、由8Al+3Fe3O4
4Al2O3+9Fe可知,反应物和生成物都是一种单质和一种化合物,属于置换反应.正确.
C、CH4+2O2
CO2+2H2O中,氧气属于单质,该反应不属于复分解反应.错误.
D、甲烷燃烧的反应属于放热反应,不是吸热反应.错误.
故选:B.
| ||
B、由8Al+3Fe3O4
| ||
C、CH4+2O2
| ||
D、甲烷燃烧的反应属于放热反应,不是吸热反应.错误.
故选:B.
点评:化学反应有的吸收热量,有的放出热量,燃烧时都放出热量,即燃烧是放热的.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
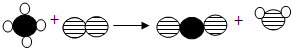 (2013?滨州模拟)若用○、
(2013?滨州模拟)若用○、 、
、 、表示不同的原子,这些相同或不相同的原子的组合可以构成不同分子,当用图示表示某个化学反应时,下列说法中,正确的是( )
、表示不同的原子,这些相同或不相同的原子的组合可以构成不同分子,当用图示表示某个化学反应时,下列说法中,正确的是( )
 (2013?广州)某同学在实验室用以下装置制备氧气并探究氧气的性质.
(2013?广州)某同学在实验室用以下装置制备氧气并探究氧气的性质.