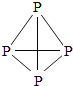题目内容
【题目】根据下列图示和相关叙述,回答下列问题:
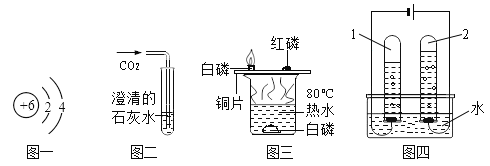
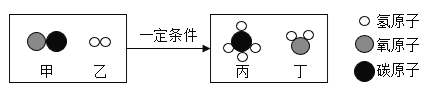
(1)图一中该元素原子有_____个电子层,最外层有_____个电子。
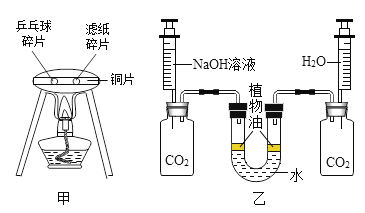
(2)图二所示的实验中,可以观察到澄清石灰水变浑浊,发生反应的化学方程式为___。
(3)如图三进行实验,观察实验现象,红磷不能燃烧为______ 。
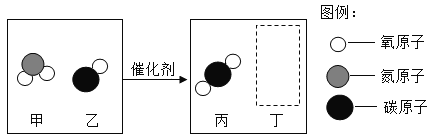
(4)图四试管“1”中的气体是____。
【答案】2 4 ![]() 没有达到着火点 氢气(或者H2)
没有达到着火点 氢气(或者H2)
【解析】
二氧化碳和氢氧化钙生成碳酸钙和水,电解水生成氢气和氧气。
(1)由图可知,图一中该元素原子有2个电子层,最外层有4个电子。
(2)图二所示的实验中发生反应是二氧化碳和氢氧化钙生成碳酸钙和水,反应的化学方程式为![]() 。
。
(3)燃烧的条件是物质是可燃物、温度达到可燃物着火点以上、有氧气参与,图三进行实验,观察实验现象,红磷不能燃烧为没有达到着火点。
(4)电解水正极生成氧气,负极生成氢气,氧气和氢气的体积比为1:2,故图四试管“1”中的气体是氢气(或者H2)。

 名校课堂系列答案
名校课堂系列答案【题目】19世纪50年代,白磷火柴在欧洲普遍流行。19 世纪末,人们发现利用白磷做火柴的工人,易患一种磷毒性颌骨坏死的疾病,至此白磷的毒性受到关注。各国也在不同时期宣布禁止生产和销售白磷火柴,于是火柴上的白磷渐渐被红磷取代。现代火柴头主要成分是氯酸钾和硫磺,火柴盒侧面的磷皮则使用了红磷,辅料包括石蜡、二氧化锰、炭黑、黏合剂和稳定剂等。
纯净的白磷是无色透明的晶体,遇光会逐渐变黄,因而又叫黄磷。白磷剧毒,误食0.1g就能致死。白磷接触皮肤也会引起吸收中毒。白磷不溶于水,易溶于二硫化碳。经测定,白磷的分子式为P4。白磷最特殊的性质就是能在潮湿的空气中发生缓慢氧化,反应产生的部分能量以光能的形式放出,故在暗处可看到白磷发光。当缓慢氧化积累的能量达到它的着火点(40° C)时便发生自燃,因此白磷通常储存在水中。
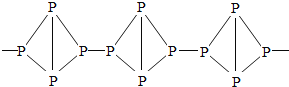
白磷和红磷虽然一字之差,但是它们的结构、着火点和毒性却有很大不同。白磷有剧毒、着火点低、是四面体型分子,而红磷无毒、着火点较高,是链状分子。
物质性质 | 白磷 | 红磷 |
毒性 | 剧毒 | 无毒 |
着火点 | 40 °C | 240 °C |
分子结构 |
|
|
依据上文,回答下列问题:
(1)白磷的物理性质_________(任写一条)。
(2)白磷燃烧反应的化学方程式为__________。
(3)现代火柴摩擦生火时燃烧的物质中,除木棍外还有_______。
(4)白磷通常保存在水中,而不放置在空气中的原因是_________。
(5)白磷与红磷性质不同的主要原因是________。