题目内容
钠是一种很活泼的金属,不仅能与酸剧烈反应,而且在常温下也能和水剧烈反应生成氢氧化钠和氢气.现把3.45g金属钠投入到一定量的水中完全反应后,所得氢氧化钠溶液的溶质质量分数为8%.
(1)写出金属钠和水反应的化学方程式并配平________;
(2)计算反应后所得氢氧化钠溶液的质量;
(3)计算反应前水的总质量.
解:(1)钠和水反应生成氢氧化钠和氢气,配平即可,故答案为:2Na+2H2O═2NaOH+H2↑
(2)设反应需要水的质量为x,可生成NaOH的质量为y
2Na+2H2O═2NaOH+H2↑
46 36 80
3.45g x y
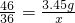
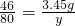
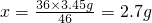
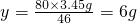
反应后所得NaOH溶液的质量为:6g÷8%=75g
(3)用参加反应的水的质量加氢氧化钠溶液中水的质量,就是反应前水的总质量.
反应前水的总质量为:2.7g+(75g-6g)g=71.7g
答:所得氢氧化钠溶液的质量为75g,反应前水的总质量为71.7g.
故答案为:(2)75g;(3)71.7g
分析:根据化学方程式计算的步骤有:一设、二写、三找、四列、五答、六查.在本题中,由题目信息可知:钠和水反应生成氢氧化钠和氢气.根据钠的质量可以求氢氧化钠的质量,然后利用质量分数公式求氢氧化钠溶液的质量.用参加反应的水的质量加氢氧化钠溶液中水的质量,就是反应前水的总质量.
点评:本考点考查了化学方程式的书写、溶质质量分数公式的应用和根据化学方程式的计算,属于溶质的质量分数和化学方程式的综合应用,是中考计算题中经常出现的题型.做题时要注意:化学方程式要写正确,本考点主要出现在计算题中.
(2)设反应需要水的质量为x,可生成NaOH的质量为y
2Na+2H2O═2NaOH+H2↑
46 36 80
3.45g x y
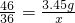
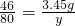
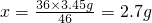
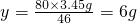
反应后所得NaOH溶液的质量为:6g÷8%=75g
(3)用参加反应的水的质量加氢氧化钠溶液中水的质量,就是反应前水的总质量.
反应前水的总质量为:2.7g+(75g-6g)g=71.7g
答:所得氢氧化钠溶液的质量为75g,反应前水的总质量为71.7g.
故答案为:(2)75g;(3)71.7g
分析:根据化学方程式计算的步骤有:一设、二写、三找、四列、五答、六查.在本题中,由题目信息可知:钠和水反应生成氢氧化钠和氢气.根据钠的质量可以求氢氧化钠的质量,然后利用质量分数公式求氢氧化钠溶液的质量.用参加反应的水的质量加氢氧化钠溶液中水的质量,就是反应前水的总质量.
点评:本考点考查了化学方程式的书写、溶质质量分数公式的应用和根据化学方程式的计算,属于溶质的质量分数和化学方程式的综合应用,是中考计算题中经常出现的题型.做题时要注意:化学方程式要写正确,本考点主要出现在计算题中.

练习册系列答案
相关题目