题目内容
硫酸是化学实验室中常用的一种试剂,试回答下列问题:
(1)配制184g质量分数为19.6%的稀硫酸,需要98%浓硫酸(密度为1.84g/cm3)______mL.
(2)在上述所得的稀硫酸中,加入足量铁粉,试计算能生成氢气多少克?
解:(1)设需要98%浓硫酸溶液的体积为V(浓硫酸),
根据配制前后溶液中的溶质质量不变,则有
184g×19.6%=98%×1.84g/cm3×V(浓硫酸),
解得V(浓硫酸)=20mL.
故答案为:20.
(2)因铁粉足量,酸完全反应,设生成氢气质量为x.
Fe+H2SO4=FeSO4+H2↑
98 2
184g×19.6% x
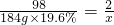
解得x=0.736g
答:能生成氢气0.736g.
分析:(1)根据溶液稀释或配制前后溶质的质量不变来列等式计算;
(2)由足量铁粉,则生成的氢气的质量由酸决定,可利用化学方程式代入酸的质量来计算氢气的质量.
点评:本题考查质量分数和化学方程式的计算,学生应注意质量守恒的应用及能代入化学方程式计算的是完全反应且纯物质的纯质量.
根据配制前后溶液中的溶质质量不变,则有
184g×19.6%=98%×1.84g/cm3×V(浓硫酸),
解得V(浓硫酸)=20mL.
故答案为:20.
(2)因铁粉足量,酸完全反应,设生成氢气质量为x.
Fe+H2SO4=FeSO4+H2↑
98 2
184g×19.6% x
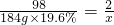
解得x=0.736g
答:能生成氢气0.736g.
分析:(1)根据溶液稀释或配制前后溶质的质量不变来列等式计算;
(2)由足量铁粉,则生成的氢气的质量由酸决定,可利用化学方程式代入酸的质量来计算氢气的质量.
点评:本题考查质量分数和化学方程式的计算,学生应注意质量守恒的应用及能代入化学方程式计算的是完全反应且纯物质的纯质量.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目