题目内容
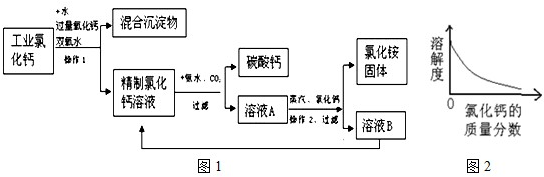
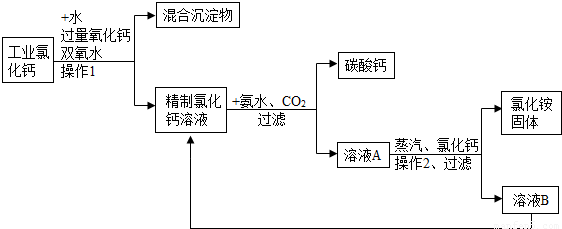
高纯碳酸钙广泛应用医药、生活生产中.如图1是由工业副产品氯化钙(含有氯化亚铁和氯化镁)制取高纯碳酸钙的工艺流程图.
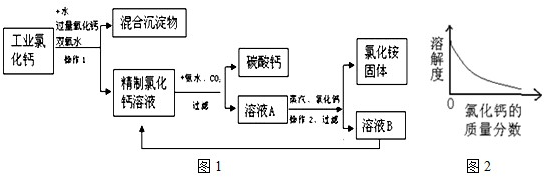
有关资料:①氯化铵受热会分解;
②在室温下,氯化铵的溶解度随氯化钙的质量分数的变化关系如图2如示.
(1)工艺流程中操作1的名称是
(2)向工业氯化钙溶液中加入氧化钙,所需氧化钙为粉末状,其目的是
(3)由氯化钙、二氧化碳、氨气和水制取碳酸钙,同时产生NH4Cl反应的化学方程式是
(4)溶液A经蒸发浓缩、操作2、加入氯化钙、过滤等过程方可获得氯化铵固体,加入适量氯化钙使得氯化铵的溶解度

有关资料:①氯化铵受热会分解;
②在室温下,氯化铵的溶解度随氯化钙的质量分数的变化关系如图2如示.
(1)工艺流程中操作1的名称是
过滤
过滤
.(2)向工业氯化钙溶液中加入氧化钙,所需氧化钙为粉末状,其目的是
增大反应物的接触面积,使其充分反应.
增大反应物的接触面积,使其充分反应.
.(3)由氯化钙、二氧化碳、氨气和水制取碳酸钙,同时产生NH4Cl反应的化学方程式是
CaCl2+CO2+2NH3+H2O=CaCO3↓+2NH4Cl
CaCl2+CO2+2NH3+H2O=CaCO3↓+2NH4Cl
.(4)溶液A经蒸发浓缩、操作2、加入氯化钙、过滤等过程方可获得氯化铵固体,加入适量氯化钙使得氯化铵的溶解度
减小
减小
(“增大”、“减小”或“不变”),从工艺成本角度考虑,该工艺流程的主要优点是节约成本或物质可循环使用.
节约成本或物质可循环使用.
.分析:(1)过滤就是把液体和不溶于液体的固体分离开的方法;
(2)把块状物体制成粉末状进行反应,可增大反应物之间的接触面积;
(3)根据反应物与生成物写出化学方程式
(4)根据氯化钙的溶解度与溶质质量分数关系曲线分析.
(2)把块状物体制成粉末状进行反应,可增大反应物之间的接触面积;
(3)根据反应物与生成物写出化学方程式
(4)根据氯化钙的溶解度与溶质质量分数关系曲线分析.
解答:解:(1)由图可看出,经过操作1后分成了混合沉淀物和精制氯化钙溶液两部分,所以操作1是采用了过滤的方法;
(2)氧化钙和水反应生成氢氧化钙;其中氧化钙为粉末状是为了增大其接触面积,使其充分反应;
(3)该反应的反应物和生成物都已经给出,只需写出方程式来配平即可,方程式为CaCl2+CO2+2NH3+H2O=CaCO3↓+2NH4Cl;
(4)向氯化铵溶液中逐渐加入氯化钙,氯化钙在溶液中的质量分数会逐渐增大,由图可知氯化铵的溶解度随氯化钙质量分数的增大而减小;从工艺流程图可看出,溶液B的主要成分是氯化钙,它并没有废弃掉而是又加入到了前面的精制氯化钙溶液中,使物质循环利用,节约成本.
故答案为:
(1)过滤;
(2)增大反应物的接触面积,使其充分反应.
(3)CaCl2+CO2+2NH3+H2O=CaCO3↓+2NH4Cl.
(4)减小;节约成本或物质可循环使用.
(2)氧化钙和水反应生成氢氧化钙;其中氧化钙为粉末状是为了增大其接触面积,使其充分反应;
(3)该反应的反应物和生成物都已经给出,只需写出方程式来配平即可,方程式为CaCl2+CO2+2NH3+H2O=CaCO3↓+2NH4Cl;
(4)向氯化铵溶液中逐渐加入氯化钙,氯化钙在溶液中的质量分数会逐渐增大,由图可知氯化铵的溶解度随氯化钙质量分数的增大而减小;从工艺流程图可看出,溶液B的主要成分是氯化钙,它并没有废弃掉而是又加入到了前面的精制氯化钙溶液中,使物质循环利用,节约成本.
故答案为:
(1)过滤;
(2)增大反应物的接触面积,使其充分反应.
(3)CaCl2+CO2+2NH3+H2O=CaCO3↓+2NH4Cl.
(4)减小;节约成本或物质可循环使用.
点评:此题问题较多,涉及到的知识点也多,考查的知识点又比较零散.做此类题最关键的一点就是要有耐心,要熟练掌握基础知识;

练习册系列答案
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案
相关题目