题目内容
【题目】将等质量的镁和铁分别放入等质量、相同质量分数的稀盐酸中,产生氢气的质量和反应时间的关系如图所示,下列说法错误的是( ) 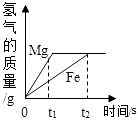
A.反应结束后镁一定有剩余
B.反应消耗盐酸的总质量一定相等
C.0﹣t1时段,产生氢气的质量镁比铁大
D.0﹣t2时段,参加反应的镁的质量与铁相等
【答案】D
【解析】解:A、如图最终生成的氢气质量相等,则消耗的盐酸质量相等,那么根据反应方程式可知Mg消耗得少、Fe消耗得多,已知根据“等质量的镁粉和铁粉”,因此镁一定有剩余,那么故A说法正确; B、由图可知生成的氢气质量是相等的,则参加反应的盐酸的质量也是相等的,故说法正确;
C、由图可知,0﹣t1时段,产生氢气的质量曲线镁在铁的上方,即镁的比铁的多,故说法正确;
D、0﹣t2时段产生的氢气相等,而反应中生成氢气质量相等,根据反应方程式可知Mg消耗得少、Fe消耗得多,故说法错误.
故选项为:D.
【考点精析】解答此题的关键在于理解金属材料的选择依据的相关知识,掌握黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属.

【题目】如表列出了一些常见物质在常温下的pH范围,其中呈碱性的是( )
物质名称 | 液体肥皂 | 菠萝汁 | 柠檬汁 | 泡菜 |
pH范围 | 9.5﹣10.5 | 3.3﹣5.2 | 2.0﹣3.0 | 3.4﹣4.0 |
A.液体肥皂
B.菠萝汁
C.柠檬汁
D.泡菜
【题目】在元素周期表的指导下,利用元素之间的一些规律性知识来分类学习物质的性质,就使化学学习和研究变得有规律可循.如图所示是元素周期表的一部分.
第二周期 | 9F | 10Ne | ||||||
第三周期 | 11Na | 12_ | 13_ | 14Si | 15p | 16s | 17_ | 18Ar |
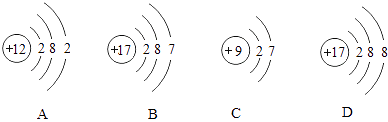
(1)地壳中含量最多的金属元素是(写元素符号),其质子数为 .
(2)地壳中硅元素的含量仅次于氧元素,硅元素的相对原子质量为 .
(3)第三周期中具有相对稳定结构的原子的原子序数为
(4)当11号元素与17号元素组成化合物时,构成此物质的阳离子的符号为 .
(5)如图所示的微粒中,属于同种元素的是(填序号),元素的化学性质相似的是(填序号),由A和D两种元素组成的物质的化学式为 .