题目内容
有质量相等的锌和铁分别和质量相等、溶液质量分数也相等的稀盐酸反应,反应的情况如图所示.则下列叙述正确的是( )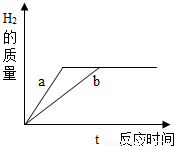
A.锌、铁都反应完,盐酸也都反应完
B.锌、铁都反应完,盐酸都有剩余
C.盐酸都反应完,铁也恰好完全反应,锌有剩余
D.盐酸都反应完,锌也恰好完全反应,铁有剩余
【答案】分析:根据金属活动性强弱关系:Zn>Fe,则在相同时间内,锌反应放出的氢气质量大于铁放出氢气质量;
根据等质量金属完全反应放出氢气质量大小关系:Fe>Zn,若质量相等的锌、铁都完全反应,铁与酸反应放出氢气的量一定大于锌与酸的反应;
解答:解:由于曲线图中两条曲线最终汇于一起,说明最终产生氢气的质量相等,则说明盐酸量不足,等质量的铁与锌完全反应产生氢气的质量铁大于锌,所以要产生等质量的氢气,消耗掉的铁的质量少,因此至少可判定金属铁未能完全反应;也可能两种金属都有剩余,或者是金属锌恰好完全反应.
A、锌、铁都反应完,根据一定质量的金属与酸完全反应放出氢气的质量= ×金属的质量可知生成氢气质量一定不相等,故错误;
×金属的质量可知生成氢气质量一定不相等,故错误;
B、锌、铁都反应完,根据一定质量的金属与酸完全反应放出氢气的质量= ×金属的质量可知生成氢气质量一定不相等,故错误;
×金属的质量可知生成氢气质量一定不相等,故错误;
C、若铁恰好完全反应,则锌一定完全反应了,锌不会有剩余,故错误;
D、产生氢气的质量相等,则说明盐酸完全反应,等质量的铁与锌完全反应产生氢气的质量铁大于锌,所以要产生等质量的氢气,消耗掉的铁的质量少,因此可判定如果金属剩余,则一定是金属铁剩余.故正确
故选D
点评:一定质量的金属与酸完全反应放出氢气的质量= ×金属的质量,利用这一经验公式,可以比较方便地解决此类金属与酸反应的问题.
×金属的质量,利用这一经验公式,可以比较方便地解决此类金属与酸反应的问题.
根据等质量金属完全反应放出氢气质量大小关系:Fe>Zn,若质量相等的锌、铁都完全反应,铁与酸反应放出氢气的量一定大于锌与酸的反应;
解答:解:由于曲线图中两条曲线最终汇于一起,说明最终产生氢气的质量相等,则说明盐酸量不足,等质量的铁与锌完全反应产生氢气的质量铁大于锌,所以要产生等质量的氢气,消耗掉的铁的质量少,因此至少可判定金属铁未能完全反应;也可能两种金属都有剩余,或者是金属锌恰好完全反应.
A、锌、铁都反应完,根据一定质量的金属与酸完全反应放出氢气的质量=
 ×金属的质量可知生成氢气质量一定不相等,故错误;
×金属的质量可知生成氢气质量一定不相等,故错误;B、锌、铁都反应完,根据一定质量的金属与酸完全反应放出氢气的质量=
 ×金属的质量可知生成氢气质量一定不相等,故错误;
×金属的质量可知生成氢气质量一定不相等,故错误;C、若铁恰好完全反应,则锌一定完全反应了,锌不会有剩余,故错误;
D、产生氢气的质量相等,则说明盐酸完全反应,等质量的铁与锌完全反应产生氢气的质量铁大于锌,所以要产生等质量的氢气,消耗掉的铁的质量少,因此可判定如果金属剩余,则一定是金属铁剩余.故正确
故选D
点评:一定质量的金属与酸完全反应放出氢气的质量=
 ×金属的质量,利用这一经验公式,可以比较方便地解决此类金属与酸反应的问题.
×金属的质量,利用这一经验公式,可以比较方便地解决此类金属与酸反应的问题. 
练习册系列答案
相关题目