题目内容
【题目】按照右图的生产流程可以制得氧化铁(铁红颜料)和硫酸钾. 
(1)写出铁与氧两种元素所形成化合物的化学式、、 .
(2)沉淀池甲中反应后生成碳酸亚铁、硫酸铵、水和一种温室气体,写出该反应的化学方程式 .
(3)该流程中加硫酸酸化的目的 .
(4)在沉淀池乙中还要加入有机溶剂丙醇,其原因可能是 .
(5)滤液X中含有KCl和(NH4)2SO4 , 在农业上的用途是 .
【答案】
(1)FeO;Fe2O3;Fe3O4
(2)FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+H2O+CO2↑
(3)是为了除去过多的NH4HCO3 .
(4)K2SO4难溶于有机溶剂丙醇.
(5)用作复合肥.
【解析】解:(1)铁与氧两种元素所形成化合物有氧化亚铁、氧化铁和四氧化三铁,化学式分别是FeO、Fe2O3、Fe3O4 . 故填:FeO;Fe2O3;Fe3O4 . (2)沉淀池甲中反应后生成碳酸亚铁、硫酸铵、水和一种温室气体,该反应的化学方程式为:FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+H2O+CO2↑.
故填:FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+H2O+CO2↑.(3)该流程中加硫酸酸化的目的是为了除去过多的NH4HCO3 .
故填:是为了除去过多的NH4HCO3 . (4)在沉淀池乙中还要加入有机溶剂丙醇,其原因可能是K2SO4难溶于有机溶剂丙醇.
故填:K2SO4难溶于有机溶剂丙醇.(5)滤液X中含有KCl和(NH4)2SO4 , 其中含有两种营养元素﹣﹣钾元素和氮元素,在农业上的用途是用作复合肥.
故填:用作复合肥.
【考点精析】认真审题,首先需要了解书写化学方程式、文字表达式、电离方程式(注意:a、配平 b、条件 c、箭号).

 名校课堂系列答案
名校课堂系列答案【题目】某兴趣小组以“稀硫酸与氢氧化钠溶液能否发生反应”为课题进行了科学探究.如图1所示,小组同学向烧杯中的氢氧化钠溶液加入稀硫酸.一会儿发现忘记了滴加指示剂,因此,他们停止滴加稀硫酸,并对烧杯内稀硫酸与氢氧化钠溶液是否发生了反应进行探究. 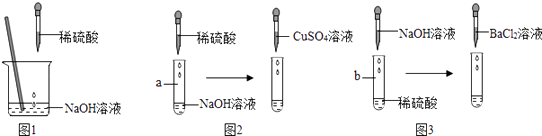
(1)小组同学设计了以下实验方案:
实验步骤 | 实验现象 | 实验结论 |
在白瓷板上放一小片pH试纸,用玻璃棒蘸取少量反应后的溶液滴在pH试纸上,把试纸显示的颜色与标准比色卡比较,读溶液的pH | pH7 | 稀硫酸与氢氧化钠溶液发生了反应,且稀硫酸过量了. |
(2)写出该反应的化学方程式: .
(3)同学们经过讨论一致认为,不用上述方法,用其他试剂也可以证明稀硫酸与氢氧化钠溶液能发生反应.于是分成甲、乙两组继续试验. 甲组实验:探究CuSO4溶液是否可以证明稀硫酸与氢氧化钠溶液发生反应.
【实验操作及现象】如图2,向a试管中滴加足量稀硫酸时无明显现象,再滴加CuSO4溶液时没有出现蓝色沉淀.
【实验结论】通过以上实验操作及现象,你认为用CuSO4溶液(填“可以”或“不可以”)证明稀硫酸与氢氧化钠溶液能发生反应.
乙组实验:探究BaCl2溶液是否可以证明稀硫酸与氢氧化钠溶液发生反应.
【实验操作及现象】如图3,向b试管中滴加足量NaOH溶液时无明显现象,再滴加BaCl2溶液时出现白色沉淀.
【实验结论】通过以上实验操作及现象,你认为用BaCl2溶液(填“可以”或“不可以”)证明稀硫酸与氢氧化钠溶液能发生反应.理由是 .