题目内容
某同学将稀盐酸逐滴加入AgNO3溶液中,直至过量.下列图象能正确表示该变化过程的是
- A.
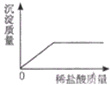
- B.

- C.

- D.

A
分析:根据稀盐酸与硝酸银反应的知识进行分析,稀盐酸能与硝酸银反应生成氯化银沉淀和稀硝酸.
解答:A、稀盐酸能与硝酸银反应生成氯化银沉淀和稀硝酸,当硝酸银全部参加反应,氯化银的质量不再发生改变,故A合理;
B、稀盐酸能与硝酸银反应生成氯化银沉淀和稀硝酸,当硝酸银全部参加反应,氯化银的质量不再发生改变,因此沉淀质量不会一直增加,故B错误;
C、稀盐酸能与硝酸银反应生成氯化银沉淀和稀硝酸,生成的硝酸呈酸性,故溶液的pH不会一直是7,故C错误;
D、开始时硝酸银的溶液呈中性,pH等于7,不会是开始时溶液的pH小于7,故D错误;
故选A.
点评:本题考查了稀盐酸与硝酸银的反应,完成此题,可以依据反应的实质以及物质的性质进行.
分析:根据稀盐酸与硝酸银反应的知识进行分析,稀盐酸能与硝酸银反应生成氯化银沉淀和稀硝酸.
解答:A、稀盐酸能与硝酸银反应生成氯化银沉淀和稀硝酸,当硝酸银全部参加反应,氯化银的质量不再发生改变,故A合理;
B、稀盐酸能与硝酸银反应生成氯化银沉淀和稀硝酸,当硝酸银全部参加反应,氯化银的质量不再发生改变,因此沉淀质量不会一直增加,故B错误;
C、稀盐酸能与硝酸银反应生成氯化银沉淀和稀硝酸,生成的硝酸呈酸性,故溶液的pH不会一直是7,故C错误;
D、开始时硝酸银的溶液呈中性,pH等于7,不会是开始时溶液的pH小于7,故D错误;
故选A.
点评:本题考查了稀盐酸与硝酸银的反应,完成此题,可以依据反应的实质以及物质的性质进行.

练习册系列答案
相关题目
某同学对盐酸溶液与氢氧化钠溶液的反应,按图所示过程进行探究:
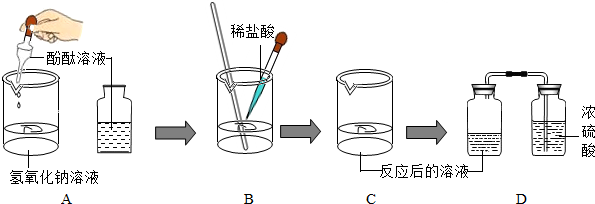
(1)填充实验过程空格项:
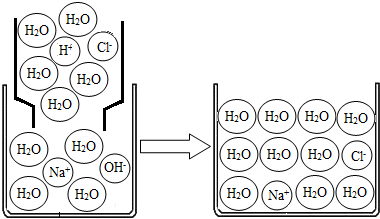
(2)模型探究:对上述过程采用微观模型加以认识,如图:
①氢氧化钠溶液与盐酸反应.反应中消失的离子有: .
②上图微观模型所反映的NaCl溶液溶质的质量分数: .

(1)填充实验过程空格项:
| 实验步骤 | 实验现象 | 实验结论 | |
| 步骤① | 取适量NaOH溶液放入烧杯中,滴入几滴酚酞试液. | ---------------------- | |
| 步骤② | 用胶头滴管将稀盐酸慢慢逐滴滴入到步骤①所得的溶液中,__________. | 溶液颜色逐渐变浅直到无色. | 氢氧化钠与稀盐酸反应. |
| 步骤③ | 当滴加稀盐酸至发生上述现象出现,立即停止. | -------------------- | ---------------------- |
| 步骤④ | 将③所得溶液移入广口瓶,并与盛有浓硫酸的广口瓶用导管连接导通,放置一段时间. | ______________. | ______________. |
①氢氧化钠溶液与盐酸反应.反应中消失的离子有:
②上图微观模型所反映的NaCl溶液溶质的质量分数:

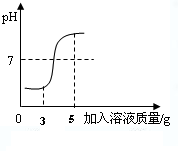
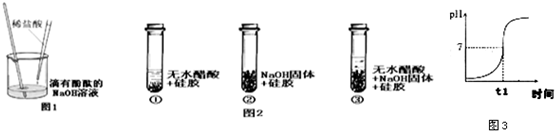
 (2013?历城区一模)在用稀盐酸和氢氧化钠溶液研究中和反应实验时,某化学兴趣小组认真观察、详实记录,进行了一些探究活动.请完成下列问题:
(2013?历城区一模)在用稀盐酸和氢氧化钠溶液研究中和反应实验时,某化学兴趣小组认真观察、详实记录,进行了一些探究活动.请完成下列问题: (2013?大庆)在中学所学的化学反应中,有很多反应没有明显现象.某探究小组想通过实验来证明某些无现象的反应确实发生了,他们做了以下探究过程.
(2013?大庆)在中学所学的化学反应中,有很多反应没有明显现象.某探究小组想通过实验来证明某些无现象的反应确实发生了,他们做了以下探究过程.