题目内容
【题目】工业上利用生产钛白的副产品硫酸亚铁制备还原铁粉的流程如图 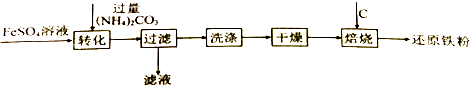
(1)“转化”时在溶液中生成了FeCO3沉淀,从四种基本反应类型来看,该反应的类型是;“过滤”后得到的滤液中的溶质有和(填化学式)
(2)“干燥”过程中有少量的FeCO3转化为FeOOH和CO2 , 此时与FeCO3反应的物质有(填化学式);FeCO3和FeOOH在空气中焙烧转化为Fe2O3 , 写出Fe2O3在高温条件下与C反应生成Fe和CO2的化学方程式 .
(3)制得的还原铁粉中含有Fe和少量FexC.为确定FexC的化学式,进行了如下实验: ①取14.06g还原铁粉在氧气流中充分加热,得到0.22gCO2;
②另取相同质量的还原铁粉与足量稀硫酸充分反应(FexC与稀硫酸不反应),得到0.48gH2 . FexC的化学式是 .
【答案】
(1)复分解反应;(NH4)2SO4;(NH4)2CO3
(2)O2;3C+2Fe2O3![]() 4Fe+3CO2↑
4Fe+3CO2↑
(3)Fe2C
【解析】解:(1)根据反应流程可知:硫酸亚铁与碳酸铵反应,生成碳酸铁沉淀和硫酸铵,该反应是两种化合物相互交换成分,生成两种新的化合物,属于复分解反应;由于碳酸铵过量,“过滤”后得到的滤液中的溶质有(NH4)2SO4和(NH4)2CO3;(2)“干燥”过程中有少量的FeCO3转化为FeOOH和CO2,此时与FeCO3反应的物质有氧气,碳可把氧化铁还原为铁,同时生成二氧化碳,化学方程式为:3C+2Fe2O3 ![]() 4Fe+3CO2↑;(3)0.22g二氧化碳中所含C元素的质量为:0.22g×
4Fe+3CO2↑;(3)0.22g二氧化碳中所含C元素的质量为:0.22g× ![]() =0.06g,设生成0.48g氢气需要单质铁的质量为a
=0.06g,设生成0.48g氢气需要单质铁的质量为a
Fe+H2SO4═FeSO4+ | H2↑ |
56 | 2 |
a | 0.48g |
![]()
a=13.44g
则量FexC中铁元素的质量为14.06g﹣13.44g﹣0.06g=0.56g
FexC中铁、碳元素的质量比为56x:12=0.56g:0.06g
x=2
故FexC的化学式为Fe2C.
答案:(1)复分解反应;(NH4)2SO4;(NH4)2CO3;(2)O2;3C+2Fe2O3 ![]() 4Fe+3CO2↑;(3)Fe2C.
4Fe+3CO2↑;(3)Fe2C.
【考点精析】通过灵活运用书写化学方程式、文字表达式、电离方程式,掌握注意:a、配平 b、条件 c、箭号即可以解答此题.


