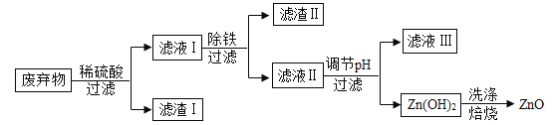
题目内容
规范的操作是实验成功的保证。下列实验操作正确的是( )
A. 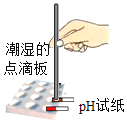 测溶液的pH B.
测溶液的pH B. 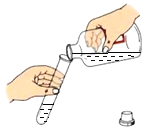 向试管中倾倒液体
向试管中倾倒液体
C. 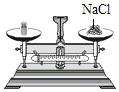 称量固体 D.
称量固体 D. 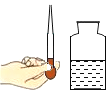 取用液体
取用液体
 阅读快车系列答案
阅读快车系列答案某研究性学习小组以“酸与碱能否发生反应”为课题进行了实验探究。
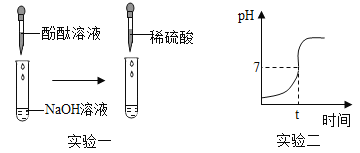
(实验一)
(1)向滴有酚酞试液的NaOH溶液中滴入稀硫酸,观察到溶液颜色由_____,证明硫酸和氢氧化钠发生了反应,该反应的化学方程式为_____。
(2)继续往上述反应后的溶液中逐滴滴入NaOH溶液,不断振荡,如果观察到_____现象,证明了滴加的稀硫酸过量。
(实验二)测量酸和碱反应过程的pH
(1)实验过程中用传感器实时获得溶液的pH,要得到如图所得变化曲线,所进行的操作是_____(填字母)。
A将稀硫酸溶液逐滴滴加到氢氧化钠溶液中
B将氢氧化钠溶液逐滴滴加到稀硫酸溶液中
(2)根据如图2溶液pH变化,判断酸和碱发生反应的依据是_____。
(实验三)小组同学经过讨论,一致认为除了上述方法外,还可以按照如表实验方法证明硫酸和氢氧化钠发生了反应。
实验步骤 | 实验现象 | 实验结论 |
取少量氢氧化钠溶液于试管中,加入过量的稀硫酸,再加入少量的氧化铜 | _____ | 氢氧化钠和硫酸发生了化学反应 |
(拓展延伸)在实验室,某同学将氢氧化钠溶液逐滴滴入稀硫酸和硫酸铜的混合溶液中至过量。加入氢氧化钠溶液的质量(横轴)与生成沉淀质量(纵轴)的关系如图所示:
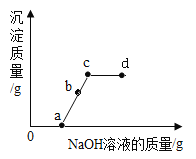
(1)图中a→c线段对应的现象是_____;
(2)图中b点处溶液中的溶质是_____;
(3)实验结束后(图中d点处)的溶液不能直接向外排放的原因是_____。
化学与人类的生活密切相关。下列对化学知识的应用归纳完全正确的一组是( )
A.化学与资源 | B.化学与安全 |
①太阳能、煤、石油、天然气都是可再生资源 ②我国试采新能源“可燃冰”已经成功 | ①在室内放一盆水能防止煤气中毒 ②用甲醛的水溶液浸泡海产品防腐 |
C.化学与生活 | D.化学与环境 |
①铵盐在农业生产中常用作氮肥,使用时不能与石灰、草木灰混合 ②用灼烧闻气味的方法区别棉纤维和羊毛纤维 | ①目前,二氧化碳、臭氧等物质计入“空气污染指数” ②使用可降解的塑料可减少“白色污染” |
A.A B.B C.C D.D
某研究性学习小组查阅资料获得以下信息:
①钾、钙、钠等活泼金属能和冷水发生反应,且能在CO2气体中燃烧。
③氧化钠和水反应生成氢氧化钠。该小组同学将钠置于充满CO2的集气瓶中进行燃烧,反应后集气瓶内有黑色固体和白色固体生成。
(1)若钠着火,可以选用的灭火物质是____(填字母序号)。
A 水 B 泡沫灭火剂 C 干沙土 D 二氧化碳
(2)该小组同学经分析得知,白色固体中不可能有NaOH,原因是_________。
他们对白色物质的成分进一步进行讨论并提出了如下假设:
Ⅰ.白色物质是Na2O;
Ⅱ.白色物质是Na2CO3;
Ⅲ.白色物质还可能是Na2O和Na2CO3。
(3)为确定瓶内白色物质的成分,该小组进行了如下实验:
实验步骤 | 实验现象 |
a.取少量白色物质于试管中,加入适量水,振荡 | 样品全部溶于水 |
b.向上述所得溶液中加入过量的CaCl2溶液,静置 | 出现白色沉淀 |
c.取静置后的上层清液于试管中,滴加无色酚酞溶液 | 无明显现象 |
①对上述实验的分析,你认为上述三个假设中,__(填“I”" II”或“Ⅲ”)成立。
②写出实验步骤b中反应的化学方程式:________。
③钠在CO2中燃烧的化学方程式为_____________。
现有一包黑色固体粉末,可能含有炭粉、氧化铜、四氧化三铁中的两种或者三种,某化学兴趣小组通过实验探究其成分。
(提出问题):该黑色固体粉末成分是什么?
(作出猜想):
猜想一:混合固体是炭粉、氧化铜 猜想二:混合固体是炭粉、四氧化三铁
猜想三:混合固体是氧化铜、 四氧化三铁 猜想四:混合固体是______
(查阅资料):
①Fe3O4能与盐酸反应
②含有Fe3+的盐溶液遇到KSCN(硫氰化钾)溶液时变成红色
③Fe(OH)2是一种白色沉淀,化学性质不稳定,最终转化为红褐色沉淀
(定性探究):

(1)在“操作”中需要用的玻璃仪器有:烧杯、玻璃棒、_____,玻璃棒的作用为_____,所得滤渣为______(填化学式);
(2)取滤液进行如下探究:(表格内填化学式)
实验操作 | 实验现象 | 实验结论 |
步骤一:取一定量的滤液于试管中,加入足量的铁粉 | 无红色固体析出 | 该固体中一定没有____ |
步骤二:又取一定量的滤液于试管中,加入少量的KSCN(硫氰化钾)溶液 | 溶液变成红色 | 滤液中一定含有的物质是______ |
步骤三:再取一定量的滤液于试管中,加入足量的NaOH溶液 | 有红褐色沉淀生成,同时还有少量的白色沉淀生成,白色沉淀迅速变成灰绿色,最终全部变成红褐色 | 滤液中还一定含有的物质是___ |
(讨论交流):
(1)步骤三中滤液里加入氢氧化钠溶液产生红褐色沉淀化学方程式是_____;
(2)通过以上实验,猜想 ________成立;
(3)Fe3O4与盐酸反应时元素的化合价没有改变,请大家推断Fe3O4中铁元素的化合价为____、____;
(4)现取该黑色粉末,经过以下操作,将该粉末中的铁元素全部转化为铁单质:步骤:_____。
(定量分析):
该化学兴趣小组取5g该黑色粉末,加入足量的盐酸后得到0.6g滤渣,则该黑色粉中的其他元素的质量分别是____?(写出计算过程,结果保留一位小数)


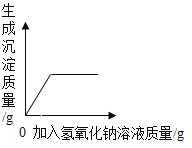 向稀硫酸和硫酸铁的混合溶液中滴加氢氧化钠溶液直至过量
向稀硫酸和硫酸铁的混合溶液中滴加氢氧化钠溶液直至过量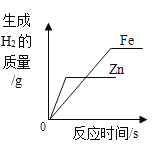 相同质量的铁和锌分别与质量分数相同的足量稀盐酸反应
相同质量的铁和锌分别与质量分数相同的足量稀盐酸反应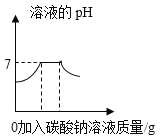 向一定量氯化钡与盐酸的混合溶液中逐滴加入碳酸钠溶液至过量
向一定量氯化钡与盐酸的混合溶液中逐滴加入碳酸钠溶液至过量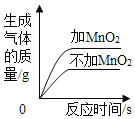 用两份等质量、等浓度的过氧化氢溶液制氧气,其中一份加入少量MnO2
用两份等质量、等浓度的过氧化氢溶液制氧气,其中一份加入少量MnO2