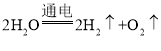题目内容
【题目】以菱锌矿(主要成分是ZnCO3,杂质为FeO、CuO)为原料制备七水硫酸锌(ZnSO4﹒7H2O),回答下列问题:
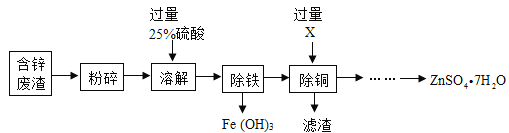
(1)“溶解”时矿石中主要成分发生反应的化学方程式为__________________。若该过程需要的25%的稀硫酸,用一定浓度的浓硫酸进行配制,需要用到的仪器有胶头滴管、玻璃棒、烧杯和___________,其中玻璃棒的作用是_____________________。
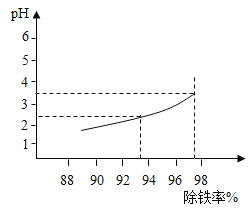
(2)“除铁”中溶液的酸碱度对除铁效果的影响如图所示,由图可知,除铁时pH应控制在_________为宜;
(3)物质X是___________,滤渣的成分是_______________。
(4)流程中获得七水硫酸锌前省略的操作是______________、冷却结晶,过滤、洗涤和低温烘干。
【答案】![]() 量筒 加速热量的散失 3.5 Zn Zn、Cu 加热浓缩
量筒 加速热量的散失 3.5 Zn Zn、Cu 加热浓缩
【解析】
题目要求以菱锌矿(主要成分是ZnCO3,杂质为FeO、CuO)为原料,通过反应除杂,制备七水硫酸锌(ZnSO4﹒7H2O)。
(1)矿石中主要成分是ZnCO3,在溶解过程中与硫酸发生反应,化学方程式为![]() 。用一定浓度的浓硫酸进行配制该过程需要的25%的稀硫酸,浓溶液配制稀溶液,只需要溶剂水,所以不需要用到天平,需要用到的仪器有胶头滴管、玻璃棒、烧杯和量筒,其中玻璃棒的作用是搅拌,加速热量的散失,防止浓硫酸飞溅出来。
。用一定浓度的浓硫酸进行配制该过程需要的25%的稀硫酸,浓溶液配制稀溶液,只需要溶剂水,所以不需要用到天平,需要用到的仪器有胶头滴管、玻璃棒、烧杯和量筒,其中玻璃棒的作用是搅拌,加速热量的散失,防止浓硫酸飞溅出来。
(2)根据地图示分析,在溶液的pH约为3.5时,“除铁”达到97%左右,所以除铁时溶液pH应控制在3.5为宜。
(3)除去铁后,溶液中含有的溶质有硫酸铜和硫酸锌,要制取硫酸锌晶体,加入过量物质X是为了除去硫酸铜,但又不能引进其他杂质,所以X为Zn,锌与硫酸铜反应生成铜和硫酸锌,因此,滤渣的成分是铜和过量的锌。
(4)因为硫酸锌的溶解度随温度变化比较大,所以从溶液析出七水硫酸锌晶体操作是加热浓缩、冷却结晶,过滤、洗涤和低温烘干。