题目内容
在农村,每年冬季因燃煤取暖而造成煤气中毒的事故屡见不鲜.某中学研究性学习小组,决定对家庭使用煤炉取暖产生尾气的成分进行探究.他们根据碳的化学性质猜测:尾气的主要成分可能为一氧化碳和二氧化碳.在收集尾气后,利用下面的装置进行实验.请回答:
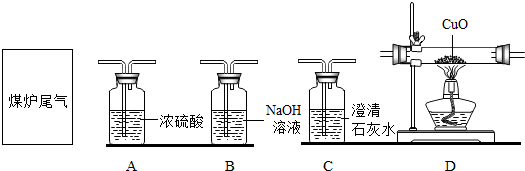
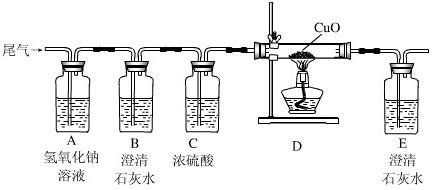
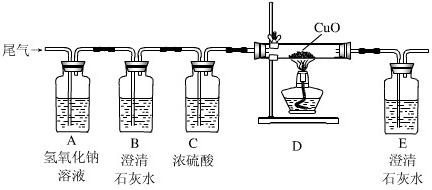
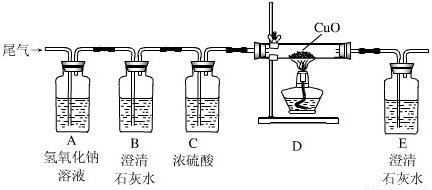
(1)为证明尾气中有二氧化碳,他们应先将收集到的气体通过装置 ;(填编号,下同)反应的化学方程式是 .
(2)为确定尾气中是否含有一氧化碳,将尾气通入装置D前,应先将气体通过装置 和 ,目的是 、 .
(3)实验中要两次用到装置C,其中第二次的作用是 .
(4)本实验中D中固体出现 的现象,反应方程式是 .
(5)经实验探究,他们证实了自己的猜测.据此,你对家庭燃煤取暖有哪些建议?

(1)为证明尾气中有二氧化碳,他们应先将收集到的气体通过装置
(2)为确定尾气中是否含有一氧化碳,将尾气通入装置D前,应先将气体通过装置
(3)实验中要两次用到装置C,其中第二次的作用是
(4)本实验中D中固体出现
(5)经实验探究,他们证实了自己的猜测.据此,你对家庭燃煤取暖有哪些建议?
分析:(1)根据二氧化碳使澄清的石灰水变浑浊分析;
(2)根据二氧化碳能和氢氧化钠反应以及浓硫酸具有吸水性进行分析;
(3)根据二氧化碳与石灰水反应有白色沉淀生成,两次都是验证二氧化碳的存在;
(4)根据一氧化碳具有还原性,能和氧化铜反应生成铜和二氧化碳进行解答;
(5)根据燃烧的条件,增大氧气的接触面积可以使燃料充分燃烧进行解答.
(2)根据二氧化碳能和氢氧化钠反应以及浓硫酸具有吸水性进行分析;
(3)根据二氧化碳与石灰水反应有白色沉淀生成,两次都是验证二氧化碳的存在;
(4)根据一氧化碳具有还原性,能和氧化铜反应生成铜和二氧化碳进行解答;
(5)根据燃烧的条件,增大氧气的接触面积可以使燃料充分燃烧进行解答.
解答:解:本实验给定的实验要求是检验尾气中含有一氧化碳和二氧化碳,检验二氧化碳需要用澄清的石灰水,而检验一氧化碳需要将一氧化碳转化为二氧化碳后检验(也可以借助氧化铜变红来分析,因为二氧化碳不具有还原氧化铜的性质).所以检验二氧化碳在线,且未来检验一氧化碳,需要将在二氧化碳检验后吸收掉,这样才能检验转化和检验一氧化碳.检验二氧化碳用澄清石灰水,吸收二氧化碳用氢氧化钠溶液,转化一氧化碳用氧化铜,在转化前进行干燥.
所以相对较为周全的设计为:尾气→澄清石灰水(检验二氧化碳)→氢氧化钠溶液(吸收二氧化碳)→澄清石灰水(检验二氧化碳是否吸收彻底)→浓硫酸(除去水蒸气)→灼热氧化铜(转化和检验一氧化碳)→澄清石灰水(检验生成了二氧化碳,从而确定一氧化碳,此步也可以不用,因为氧化铁变为红色也说明还原性物质存在.所以不同的关注点,可以有不同的实验).
故答案为:(1)C;Ca(OH)2+CO2=CaCO3↓+H2O;
(2)B;A;除去尾气中的CO2;除去尾气通过NaOH溶液后引入的少量水蒸气;
(3)验证CO还原CuO后有CO2生成,从而证明尾气中含有CO;
(4)变红;CuO+CO
Cu+CO2;
(5)使煤充分燃烧,注意通风排气,外出和睡觉前,一定要熄灭炉火.
所以相对较为周全的设计为:尾气→澄清石灰水(检验二氧化碳)→氢氧化钠溶液(吸收二氧化碳)→澄清石灰水(检验二氧化碳是否吸收彻底)→浓硫酸(除去水蒸气)→灼热氧化铜(转化和检验一氧化碳)→澄清石灰水(检验生成了二氧化碳,从而确定一氧化碳,此步也可以不用,因为氧化铁变为红色也说明还原性物质存在.所以不同的关注点,可以有不同的实验).
故答案为:(1)C;Ca(OH)2+CO2=CaCO3↓+H2O;
(2)B;A;除去尾气中的CO2;除去尾气通过NaOH溶液后引入的少量水蒸气;
(3)验证CO还原CuO后有CO2生成,从而证明尾气中含有CO;
(4)变红;CuO+CO
| ||
(5)使煤充分燃烧,注意通风排气,外出和睡觉前,一定要熄灭炉火.
点评:对于混合物成分的检验和确定,一是注意所使用的检验原理,从而根据不同原理设计不同的实验,二是在设计中注意各个环节的相互印证的设计,从而保证结论的准确无误.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目