题目内容
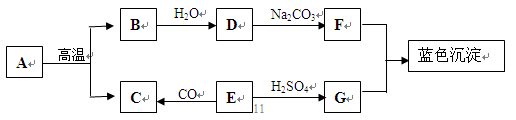
下图是用铜粉氧化法生产氧化铜的流程图。据图回答下列问题:
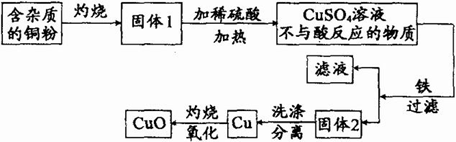
(1)铜粉灼烧后可能有氧化铜和氧化亚铜两种物质。氧化亚铜(Cu2O)中铜元素的化合价是_____价。
(2)已知氧化亚铜和稀硫酸反应可生成硫酸铜和铜。假如固体1中只含有铜的氧化物,下列推理合理的是___________(填序号)。
①固体1中加入稀硫酸,若溶液呈蓝色,说明该固体中一定有氧化铜
②固体1中加入稀硫酸,若有红色沉淀物,说明该固体中一定有氧化亚铜
(3)将得到的1.6吨氧化铜全部转化为硫酸铜,可得硫酸铜多少吨?(CuO+H2SO4=CuS04+H2O)
(4)若用贴有如图标签的浓硫酸100毫升可配制溶质质量分数为49%的硫酸溶液_____克。

(1)铜粉灼烧后可能有氧化铜和氧化亚铜两种物质。氧化亚铜(Cu2O)中铜元素的化合价是_____价。
(2)已知氧化亚铜和稀硫酸反应可生成硫酸铜和铜。假如固体1中只含有铜的氧化物,下列推理合理的是___________(填序号)。
①固体1中加入稀硫酸,若溶液呈蓝色,说明该固体中一定有氧化铜
②固体1中加入稀硫酸,若有红色沉淀物,说明该固体中一定有氧化亚铜
(3)将得到的1.6吨氧化铜全部转化为硫酸铜,可得硫酸铜多少吨?(CuO+H2SO4=CuS04+H2O)
(4)若用贴有如图标签的浓硫酸100毫升可配制溶质质量分数为49%的硫酸溶液_____克。
| 硫酸(500mL) 品名:硫酸 化学式:H2SO4 相对分子质量:98 密度:1.84g/cm3 溶质质量分数:98% |
:(1)+1 (2)② (3)设可生成硫酸铜质量为X,则
CuO+H2SO4=CuSO4+H2O
80 160
1.6吨 X
80∶160=1.6吨∶X
X=3.2吨
答:可生成硫酸铜3.2吨。
(4)368
CuO+H2SO4=CuSO4+H2O
80 160
1.6吨 X
80∶160=1.6吨∶X
X=3.2吨
答:可生成硫酸铜3.2吨。
(4)368
(1)根据在化合物中正负化合价代数和为零,可设氧化亚铜(Cu2O)中铜元素的化合价为x,2x+(-2)=0;x=+1;故答案为:+1;
(2)①因为Cu2O和CuO与稀硫酸反应都生成蓝色的硫酸铜,所以固体中可能有氧化铜也可能含有Cu2O,故①错误;
②因为氧化亚铜和稀硫酸反应可生成硫酸铜和铜,所以只要有铜存在,就说明一定含有氧化亚铜,故②正确;
故选②;
(3)设可生成硫酸铜质量为X,则
CuO+H2SO4=CuSO4+H2O
80 160
1.6吨 X
80∶160=1.6吨∶X
X=3.2吨
答:可生成硫酸铜3.2吨。
(4)根据稀释溶液过程中溶质守恒;
设可配制溶质质量分数为49%的硫酸溶液m克
100 cm3?1.84g/cm3?98%=m?49%
m=368g
(2)①因为Cu2O和CuO与稀硫酸反应都生成蓝色的硫酸铜,所以固体中可能有氧化铜也可能含有Cu2O,故①错误;
②因为氧化亚铜和稀硫酸反应可生成硫酸铜和铜,所以只要有铜存在,就说明一定含有氧化亚铜,故②正确;
故选②;
(3)设可生成硫酸铜质量为X,则
CuO+H2SO4=CuSO4+H2O
80 160
1.6吨 X
80∶160=1.6吨∶X
X=3.2吨
答:可生成硫酸铜3.2吨。
(4)根据稀释溶液过程中溶质守恒;
设可配制溶质质量分数为49%的硫酸溶液m克
100 cm3?1.84g/cm3?98%=m?49%
m=368g

练习册系列答案
相关题目