题目内容
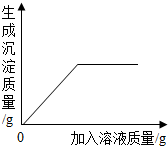
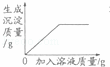
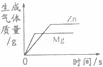
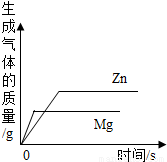
等质量的镁和锌分别放置在两只烧杯中,向其中分别逐滴加入质量分数相等的稀硫酸下图一定不正确的是( )
分析:依据镁的金属活动性比锌强,所以与质量分数相等的稀硫酸反应是速度要快,而氢气归根结底是来源于酸中的氢元素,所以消耗的酸的质量相等时生成的氢气量一定相等;
解答:解:A、由于镁的金属活动性比锌强,所以与质量分数相等的稀硫酸反应是速度要快,所以镁的图象会陡一些,至结束时由于同质量的镁与锌是镁生成氢气较多(氢气的质量=
×金属的质量),所以最终镁的图象在锌的上方,图示图象符合以上结论,故正确;
B、由A的分析可知镁的反应速度更快一些,而图象所示锌的反应速度更快,所以该图象表示错误;
C、由于消耗相同的硫酸时生成的氢气质量会相等,所以一开始应该是一条重合的图象,至锌镁完全反应时镁生成的氢气要更多一些,图示图象符合以上结论,故正确;
D、由于消耗相同的硫酸时生成的氢气质量会相等,所以一开始应该是一条重合的图象,但该图象不能反映该结论,故该图象一定错误;
故选BD
| 金属的化合价 |
| 金属的相对原子质量 |
B、由A的分析可知镁的反应速度更快一些,而图象所示锌的反应速度更快,所以该图象表示错误;
C、由于消耗相同的硫酸时生成的氢气质量会相等,所以一开始应该是一条重合的图象,至锌镁完全反应时镁生成的氢气要更多一些,图示图象符合以上结论,故正确;
D、由于消耗相同的硫酸时生成的氢气质量会相等,所以一开始应该是一条重合的图象,但该图象不能反映该结论,故该图象一定错误;
故选BD
点评:本题主要考查学生根据金属的性质和原子的相对质量进行分析问题的能力,读懂图象所反映的问题是解题的关键;

练习册系列答案
相关题目
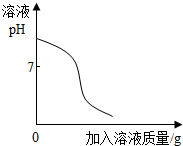
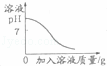
下列图象能正确反映其对应关系的是( )
|
| A. |
某温度下,向一定量接近饱和的硝酸钾溶液中不断加入过量的硝酸钾晶体 |
|
| B. |
向稀盐酸和硫酸钠的混合溶液中加入过量的氢氧化钡溶液 |
|
| C. |
向氢氧化钠溶液中滴加过量的稀盐酸 |
|
| D. |
等质量的镁和锌同时分别放入两份溶质质量分数相同的足量稀盐酸中 |