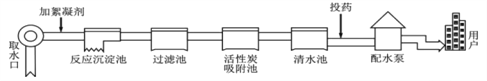
题目内容
【题目】如图是a、b、c三种物质的溶解度曲线,下列说法错误的是
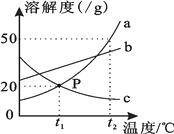
A. t2℃时三种物质的溶解度由大到小的顺序是a>b>c
B. P点表示t1℃时,a、c两种物质的饱和溶液的溶质质量分数相等
C. 将t2℃时a、b的饱和溶液降温至t1℃,析出晶体a比b多
D. t2℃时,将30g a物质加入到50g水中充分搅拌,得到75ga的饱和溶液
【答案】C
【解析】A. 在溶解度曲线图上,横坐标是温度,纵坐标是溶解度。 t2℃时三种物质的溶解度由大到小的顺序是a>b>c,正确;B. P点表示t1℃时,a、c两种物质的溶解度相等, ![]() ,t1℃时,a、c两种物质的饱和溶液的溶质质量分数相等,正确;C. 将t2℃时等质量的a、b的饱和溶液降温至t1℃,析出晶体a比b多,错误;D. 溶解度是一定温度下,100g溶剂里达到饱和时,所溶解的溶质的质量。t2℃时,a的溶解度为50g,将30g a物质加入到50g水中充分搅拌,溶解25g a,得到75ga的饱和溶液,正确。故选C。
,t1℃时,a、c两种物质的饱和溶液的溶质质量分数相等,正确;C. 将t2℃时等质量的a、b的饱和溶液降温至t1℃,析出晶体a比b多,错误;D. 溶解度是一定温度下,100g溶剂里达到饱和时,所溶解的溶质的质量。t2℃时,a的溶解度为50g,将30g a物质加入到50g水中充分搅拌,溶解25g a,得到75ga的饱和溶液,正确。故选C。

【题目】学习酸碱盐知识后,同学们知道碳酸钠溶液与氢氧化钙溶液能发生反应,可观察到溶液变浑浊。甲组同学进行右图所示的实验,却未观察到预期现象。

【提出问题】未观察到浑浊的原因是什么?
【猜想和假设】
①与氢氧化钙溶液的浓度有关。若使用更大浓度的氢氧化钙溶液,会迅速产生浑浊。
②与碳酸钠溶液的浓度有关。若使用更大浓度的碳酸钠溶液,会迅速产生浑浊。经讨论,同学们认为猜想①不合理,其理由是 。
【进行实验】乙组同学针对猜想②进行实验。
实验目的 | 实验操作 | 实验现象 | |
探究猜想② | 取4支试管,向其中分别加入 | 碳酸钠溶液浓度/% | 是否浑浊 |
10 | 不浑浊 | ||
5 | 不浑浊 | ||
1 | 浑浊 | ||
0.5 | 浑浊 | ||
【解释与结论】
(1)补全上述实验操作:取4支试管,向其中分别加入 。
(2)氢氧化钙溶液与碳酸钠溶液混合出现浑浊的化学方程式是 。
(3)乙组实验证明:猜想②不成立,碳酸钠溶液浓度在0.5~10%的范围内,能否出现浑浊与碳酸钠溶液的浓度有关,其关系是 。
【实验反思】
(1)丙组同学对乙组所做实验中未出现浑浊的原因进行探究。设计了多组实验,其中部分同学的实验过程及结果如下:

丙组同学的实验目的是 。
(2)依据乙、丙两组的实验探究,丁组同学仍使用甲组的仪器和药品对甲组实验进行了改进,当滴入几滴某溶液后,溶液迅速变浑浊。其实验操作是 。