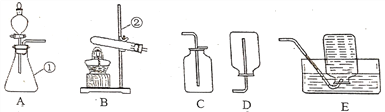
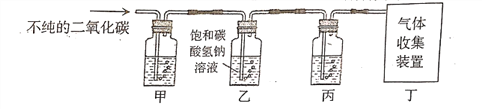
题目内容
【题目】某干燥剂含有CaO、NaOH和CaCl2中的两种物质,为探究其成分,设计如图所示实验。依据实验流程回答相关问题。

(1)溶液a一定显________性。
(2)白色固体b一定是________(填化学式)。写出可能生成白色固体的化学方程式_______________________________________________(任写一种)。
(3)加入过量的稀HNO3的目的是____________________________________________。
(4)现象c:①若无白色沉淀,干燥剂成分为____________________________________。
②若有白色沉淀,写出产生此现象的化学方程式____________________________________。干燥剂成分为____________________________________。
(5)稀HNO3溶液能否用稀HCl溶液替代_________________(填“能”或“不能”)。
【答案】 碱 CaCO3 Ca(OH)2 + Na2CO3 → CaCO3↓+ 2NaOH或CaCl2 + Na2CO3 → CaCO3↓+ 2NaCl 完全除去NaOH、Na2CO3,以免干扰检验CaCl2 CaO和NaOH NaCl + AgNO3 → AgCl↓ + NaNO3 CaO、CaCl2或NaOH、CaCl2 不能
【解析】(1)CaO、NaOH和CaCl2中的任意两种物质溶于水时,氧化钙与水反应生成氢氧化钙显碱性,氢氧化钠显碱性,故溶液一定显碱性;
(2)CaO、NaOH和CaCl2中的任意两种水溶液中一定含有钙离子,故加入碳酸钠后生成的沉淀是碳酸钙,化学式为CaCO3;氢氧化钙与碳酸钠反应生成碳酸钙和氢氧化钠反应方程式为Ca(OH)2 + Na2CO3 → CaCO3↓+ 2NaOH,氯化钙与碳酸钠反应生成碳酸钙和氯化钠,反应方程式为CaCl2 + Na2CO3 → CaCO3↓+ 2NaCl;
(3)加入过量的稀硝酸是为了除去氢氧化钠和过量的碳酸钠;
(4)现象c:①若无白色沉淀,说明溶液中没有氯离子,故干燥剂成分为CaO和NaOH ;
②若有白色沉淀,说明溶液中有氯化钙,氯化钙与硝酸银反应生成氯化银和硝酸钠,反应方程式为NaCl + AgNO3 → AgCl↓ + NaNO3;此干燥剂的成分可能是CaO、CaCl2或NaOH、CaCl2;
(5)稀HNO3溶液不能用稀HCl溶液替代,因为稀盐酸中有氯离子,对实验现象有影响;

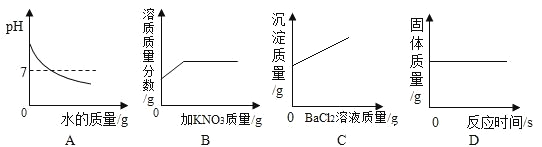
【题目】下列图象能正确反映对应变化关系的是( )
A. 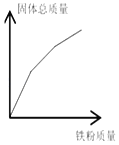 硝酸铜和硝酸银的混合溶液中加入铁粉
硝酸铜和硝酸银的混合溶液中加入铁粉
B. 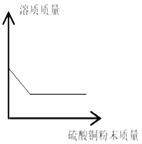 一定量的饱和硫酸铜溶液中加入硫酸铜粉末
一定量的饱和硫酸铜溶液中加入硫酸铜粉末
C.  混有盐酸的氯化钙溶液中滴加碳酸钠溶液
混有盐酸的氯化钙溶液中滴加碳酸钠溶液
D. 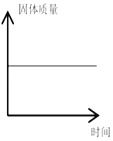 镁带在密闭容器中燃烧
镁带在密闭容器中燃烧
【题目】(1)下列实验现象的描述正确的是(______)(多选,用字母作答)
A. 将燃烧的木条伸入人体呼出的气体中,木条燃烧更旺
B.一氧化碳在空气中燃烧,产生蓝色火焰
C.将一根打磨过的铁丝伸入硫酸铜溶液中,铁丝表面有红色固体析出
D. 向滴有酚酞的NaOH溶液中逐滴滴加稀盐酸,溶液由无色变为红色
E. 将一枚生锈的铁钉浸入稀盐酸中片刻,溶液变为浅绿色
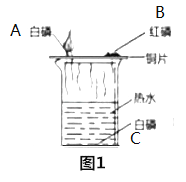
(2)请从下列甲乙两题中任选一题作答。
试题甲:探究燃烧的条件 | 试题乙:探究二氧化碳的性质 |
|
|
实验过程,能观察到燃烧现象的是 _____,(填序号),热水的作用是 _____和隔绝氧气,实验方法为控制变量法,就白磷而言,控制的变量为____。 | 实验过程中观察到,干石蕊纸花喷水后放入二氧化碳中,纸花的颜色会____ ,反应的化学方程式为____,实验方法为控制变量法,本实验控制的变量为 ______。 |