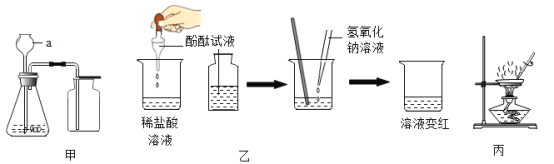
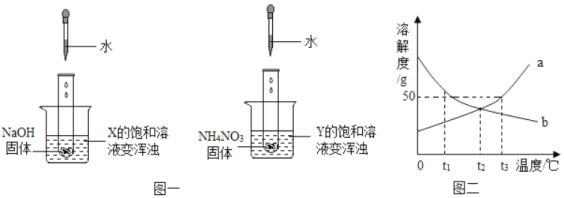
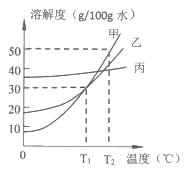
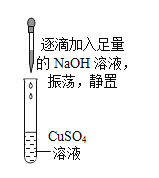
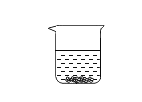
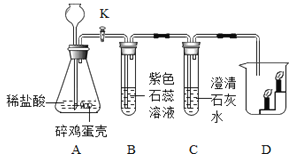
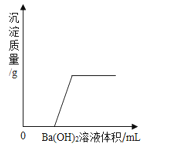
题目内容
【题目】用如图装置探究可燃物的燃烧条件并回答问题。(红磷的着火点为240℃,白磷的着火点为40℃.装置的气密性良好。)
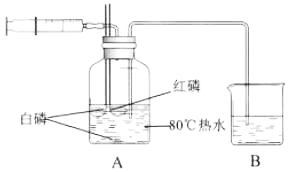
(1)用注射器向瓶内推入空气口,观察到A中现象是___、___、___。
(2)对比燃烧匙中白磷和红磷,说明可燃物的燃烧的条件是___;对比燃烧匙中白磷与水中白磷,说明可燃物的燃烧的条件是___。
(3)停止用注射器向瓶内推入空气后,A中液面仍然下降,请解释此现象的原因___。
【答案】瓶内液面下降,导气管中液面上升;燃烧匙中的白磷燃烧,产生白烟;水中白磷和红磷不燃烧 温度达到可燃物着火点 可燃物与空气或氧气接触 白磷燃烧放热,使瓶内压强增大
【解析】
(1)用注射器向瓶内推入空气,瓶内压强增大,会看到瓶内液面下降,导气管中液面上升,燃烧匙中的白磷、红磷浮出水面,过一会会观察到燃烧匙中的白磷燃烧,产生白烟;水中白磷和燃烧匙中的红磷不燃烧,故填瓶内液面下降,导气管中液面上升;燃烧匙中的白磷燃烧,产生白烟;水中白磷和红磷不燃烧。
(2)A中燃烧匙中的白磷燃烧,燃烧匙中的红磷不燃烧,对比可知可燃物的燃烧的条件是温度需达到可燃物着火点,故填温度达到可燃物着火点;
A中燃烧匙中的白磷燃烧,水中白磷不燃烧,说明可燃物的燃烧的另一个条件是可燃物与空气或氧气接触,故填可燃物与空气或氧气接触。
(3)停止用注射器向瓶内推入空气后,A中液面仍然下降,是因为白磷燃烧时释放热量,瓶中的气体受热体积膨胀,瓶中的压强增大使A中液面仍然下降,故填白磷燃烧放热,使瓶内压强增大。

 阅读快车系列答案
阅读快车系列答案【题目】元素周期表和化学用语都是学习化学的重要工具,回答下列问题:
3 Li 锂 | 4 Be 铍 | 5 B 硼 | 6 C 碳 | 7 N 氮 | 8 O 氧 | 9 F 氟 | 10 Ne 氖 |
11 Na 钠 | 12 Mg 镁 | 13 Al 铝 | 14 Si 硅 | 15 P 磷 | 16 S 硫 | 17 Cl 氯 | 18 Ar 氩 |
(1)同一周期(横行)中,相邻两种元素的质子数之差为_____;磷元素原子核外电子数为_____。
(2)第 7 号元素与第 8 号元素组成的一种化合物中,7 号元素与 8 号元素的质量比为 7∶4,则该化合物的化学式是_____。
(3)9 号元素的气体单质(F2)常温下与水发生反应,生成氢氟酸(HF)和另一种无色气体,该反应的化学方程式为:_____
【题目】兴趣小组对硫酸铜溶液进行相关实验。
实验步骤 | 实验现象 | 回答问题 | |
实验一 |
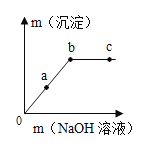
|
| (1)该反应的化学方程式___。 (2)a点时,溶液的溶质是___。 (3)b点的意义是___。 (4)c点时,观察到的现象是___。 |
实验二 |
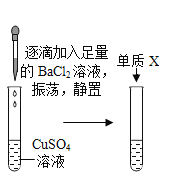
|
| (1)从溶液颜色判断加入BaCl2溶液的量___。 A 过量 B 少量 C 无法判断 (2)将反应后溶液由蓝色转变成其他颜色,可加入的固体单质X是___。 |
实验三 |
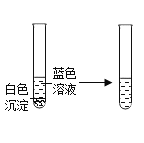
|
| 沉淀的化学式是___。 |
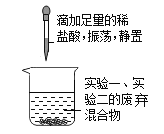
【题目】某化学兴趣小组在一次实验中进行如图所示的实验:

此时观察到U形管左右两侧产生的现象是不同的;实验后,小组同学充分振荡U形管。发现管内仍有白色固体残留。将固体分离后,同学们对滤液成分产生浓厚的兴趣,于是进行了进一步的探究活动
(1)(提出问题)滤液中可能含有哪些溶质?
(猜想与假设)猜想一:溶质为NaCl
猜想二:溶质为NaCl和BaCl2
猜想三:溶质为NaCl、BaCl2和HCl
你认为以上猜想_____不合理;理由是_____(请用化学方程式表示);请写出你的猜想_____。
(2)(实验探究)小红为了验证滤液成分,取滤液于试管中,向其中滴加少量的硫酸钠溶液,观察到无明显现象。由此得出结论:猜想一成立。小刚认为小红的结论是否严密_____(填“严密”或“不严”)。
为了验证你的猜想,请填写下表:
实验操作 | 实验现象 | 实验结论 |
取滤液适量于试管中,向其中滴加适量_____溶液 | 溶液由无色变为红色 | 你的猜想成立 |
(3)(归纳与总结)通过上述实验,我们能够总结出:在确定化学反应后所得溶液溶质成分时,除了考虑生成物外,还需要考虑_____。