题目内容
(1)在“浓硫酸、氯化钠、大理石、稀有气体、钛合金”中选用适当的物质填空.
①可用来消除公路积雪的是
③可用来制造人造骨的是
(2)现有H、O、N、C、Mg五种元素,请选用其中的元素写出符合下列要求的物质各一个(用化学式表示):
①空气中含量最多的气体
③常温易挥发的碱
①可用来消除公路积雪的是
氯化钠
氯化钠
;②可用作建筑材料的是大理石
大理石
;③可用来制造人造骨的是
钛合金
钛合金
;④可用作某些气体干燥剂的是浓硫酸
浓硫酸
.(2)现有H、O、N、C、Mg五种元素,请选用其中的元素写出符合下列要求的物质各一个(用化学式表示):
①空气中含量最多的气体
N2
N2
;②食醋中含有的酸CH3COOH
CH3COOH
;③常温易挥发的碱
NH3?H2O
NH3?H2O
;④含有金属元素的盐Mg(NO3)2或MgCO3
Mg(NO3)2或MgCO3
.分析:(1)浓硫酸具有吸水性,可用作干燥剂,氯化钠是融雪剂的主要成分之一,大理石的主要成分是碳酸钙,可用作建筑材料,钛合金与人骨有很好的相容性,可以用作制造人造骨骼;
(2)空气中含量最多的气体是氮气;食醋主要成分是乙酸,又称醋酸(CH3COOH);常温易挥发的碱是氨水;盐是由金属元素和酸根造成的化合物,含有金属元素的盐有硝酸镁、碳酸镁.
(2)空气中含量最多的气体是氮气;食醋主要成分是乙酸,又称醋酸(CH3COOH);常温易挥发的碱是氨水;盐是由金属元素和酸根造成的化合物,含有金属元素的盐有硝酸镁、碳酸镁.
解答:解:(1)①可用来消除公路积雪的是氯化钠;
②大理石可用作建筑材料;
③钛合金可用来制造人造骨;
④浓硫酸具有干燥性,可作某些气体的干燥剂;
(2)①空气中含量最多的气体是氮气,化学式是:N2;
②食醋中含有醋酸,化学式是:CH3COOH;
③氨水常温易挥发,化学式是:NH3?H2O;
④硝酸镁和碳酸镁是含有金属元素的盐,化学式是:Mg(NO3)2、MgCO3;
故答案为:
(1)①氯化钠; ②大理石; ③钛合金; ④浓硫酸;
(2)①N2; ②CH3COOH; ③NH3?H2O; ④Mg(NO3)2或MgCO3.
②大理石可用作建筑材料;
③钛合金可用来制造人造骨;
④浓硫酸具有干燥性,可作某些气体的干燥剂;
(2)①空气中含量最多的气体是氮气,化学式是:N2;
②食醋中含有醋酸,化学式是:CH3COOH;
③氨水常温易挥发,化学式是:NH3?H2O;
④硝酸镁和碳酸镁是含有金属元素的盐,化学式是:Mg(NO3)2、MgCO3;
故答案为:
(1)①氯化钠; ②大理石; ③钛合金; ④浓硫酸;
(2)①N2; ②CH3COOH; ③NH3?H2O; ④Mg(NO3)2或MgCO3.
点评:掌握物质的性质和用途方可顺利解答,很好的体现了化学知识在生活中的应用.

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目


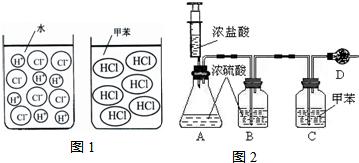 21、某化学兴趣小组的同学对氯化氢与盐酸的化学性质是否相同进行了探究.
21、某化学兴趣小组的同学对氯化氢与盐酸的化学性质是否相同进行了探究.