题目内容
某同学测定一瓶BaCl2溶液中溶质的质量分数,请回答实验中的有关问题:(1)打开试剂瓶取出10.0g该溶液置于一个洁净的烧杯中.操作中,取下瓶塞 放在桌上,理由是 .
(2)用胶头滴管向烧杯中滴加AgNO3溶液直至不再产生沉淀为止.滴加试剂时,滴管要保持 ,不要接触 ,用毕立即用蒸馏水冲洗.
(3)过滤时,要用一根洁净的 ,下端轻轻地靠在 的滤纸那边,使液体混合物沿其缓缓流入过滤器.
(4)取沉淀物于蒸发皿中加热蒸干,在充分干燥之后称量,得到沉淀物的质量是0.2g,则氯化钡溶液中溶质的质量分数为 %.(计算结果精确到0.1%)
【答案】分析:(1)取用液体药品时,先拿下瓶塞,倒放在桌上(防止沾污药品),然后拿起试剂瓶,标签要向着手心,瓶口要紧挨试管口,试管稍倾斜,将液体缓慢地倒入试管;倒完后,要将瓶口在试管口刮一下,以防残留的液体流下腐蚀标签.
(2)滴液时,滴管应悬空竖直于容器上方,不能把滴管伸入容器中;吸液后的滴管不可平放或倒置,以免试剂流入胶头,腐蚀胶头;用完的滴管要用蒸馏水清洗干净,以备下次再用.
(3)过滤时,为将液体引流至过滤器中,要用一根洁净的玻璃棒斜靠在三层滤纸的一边.
(4)依据BaCl2与AgNO3反应的化学方程式中氯化钡和氯化银之间的质量关系,可以计算出0.145g氯化钡与足量AgNO3溶液能够生成0.2gAgCl沉淀,进一步计算出BaCl2溶液中溶质的质量分数为1.45%.
解答:解:(1)取用液体药品时,先拿下瓶塞,倒放在桌上,防止沾污药品.
(2)滴液时,滴管应悬空竖直于容器上方,不要接触烧杯壁,以免沾污滴管,进一步沾污试剂瓶中的药品.
(3)过滤时,要用一根洁净的玻璃棒斜靠在三层滤纸的一边.
(4)设10.0gBaCl2溶液中含有质量为x的BaCl2,与足量AgNO3溶液能够生成0.2gAgCl沉淀.
BaCl2+2AgNO3═2AgCl↓+Ba(NO3) 2
208 287
x 0.2g
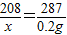
解得:x=0.145g,则BaCl2溶液中溶质的质量分数为:
则氯化钡溶液中溶质的质量分数为1.45%.
答案为:(1)倒;防止沾污药品;
(2)悬空竖直;烧杯壁;
(3)玻璃棒;三层;
(4)1.45%
点评:本题综合考查液体药品的取用、向容器中滴液及过滤等化学实验基本操作与根据化学方程式的计算.
(2)滴液时,滴管应悬空竖直于容器上方,不能把滴管伸入容器中;吸液后的滴管不可平放或倒置,以免试剂流入胶头,腐蚀胶头;用完的滴管要用蒸馏水清洗干净,以备下次再用.
(3)过滤时,为将液体引流至过滤器中,要用一根洁净的玻璃棒斜靠在三层滤纸的一边.
(4)依据BaCl2与AgNO3反应的化学方程式中氯化钡和氯化银之间的质量关系,可以计算出0.145g氯化钡与足量AgNO3溶液能够生成0.2gAgCl沉淀,进一步计算出BaCl2溶液中溶质的质量分数为1.45%.
解答:解:(1)取用液体药品时,先拿下瓶塞,倒放在桌上,防止沾污药品.
(2)滴液时,滴管应悬空竖直于容器上方,不要接触烧杯壁,以免沾污滴管,进一步沾污试剂瓶中的药品.
(3)过滤时,要用一根洁净的玻璃棒斜靠在三层滤纸的一边.
(4)设10.0gBaCl2溶液中含有质量为x的BaCl2,与足量AgNO3溶液能够生成0.2gAgCl沉淀.
BaCl2+2AgNO3═2AgCl↓+Ba(NO3) 2
208 287
x 0.2g
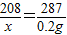
解得:x=0.145g,则BaCl2溶液中溶质的质量分数为:

则氯化钡溶液中溶质的质量分数为1.45%.
答案为:(1)倒;防止沾污药品;
(2)悬空竖直;烧杯壁;
(3)玻璃棒;三层;
(4)1.45%
点评:本题综合考查液体药品的取用、向容器中滴液及过滤等化学实验基本操作与根据化学方程式的计算.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目