题目内容
将一氧化碳和二氧化碳的混合气体,先通过足量灼热的氧化铜,再通入足量澄清的石灰水中,充分反应后得到碳酸钙的质量是原混合气体质量的3倍,则原混合气体中氧元素的质量分数为( )
| A、64% | B、32% |
| C、60% | D、49% |
考点:根据化学反应方程式的计算
专题:有关化学方程式的计算
分析:根据反应后得到碳酸钙的质量是原混合气体质量的3倍,可以假设混合气体的质量,再根据物质之间的相互转化关系可以计算原混合气体中氧元素的质量分数.
解答:解:设原混合气体质量为X,所以反应生成的CaCO3质量为3X,
由Ca(OH)2+CO2═CaCO3↓+H2O可知,CO2~CaCO3,
CO2~CaCO3,
44 100
3X
CO+CuO
Cu+CO2,气体质量增加
28 44 44-28=16
Y (132X/100)-X
设混合气体中含有CO的质量为Y,
则有:
=
,
Y=0.56X,
也就是说,原来Xg混合气体中,含有56%的CO、44%的CO2,
氧元素的质量为:X×56%×
×100%+X×44%×
×100%=
=0.64X,
原混合气体中氧元素的质量分数为:
×100%=64%,
故选:A.
由Ca(OH)2+CO2═CaCO3↓+H2O可知,CO2~CaCO3,
CO2~CaCO3,
44 100
| 132X |
| 100 |
CO+CuO
| ||
28 44 44-28=16
Y (132X/100)-X
设混合气体中含有CO的质量为Y,
则有:
| 28 |
| 16 |
| Y |
| (132X/100)-X |
Y=0.56X,
也就是说,原来Xg混合气体中,含有56%的CO、44%的CO2,
氧元素的质量为:X×56%×
| 16 |
| 28 |
| 32 |
| 44 |
| 64X |
| 100 |
原混合气体中氧元素的质量分数为:
| 0.64X |
| X |
故选:A.
点评:本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
“绿色化学”的核心是在化学反应过程或化工生产中,尽量减少使用或彻底消除有害物质.下列做法中,符合绿色化学的是( )
| A、生产和使用剧毒农药 |
| B、造纸厂用二氧化硫进行纸浆漂白 |
| C、利用红磷在氧气中燃烧制五氧化二磷 |
| D、化工厂产生的废气向高空排放 |
以下实验都不能达到实验目的,则有关分析错误的是( )
A、 测定空气中氧气的含量--反应物木炭的量太少 |
B、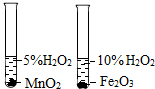 比较MnO2和Fe2O3的催化效果--双氧水的浓度不同 |
C、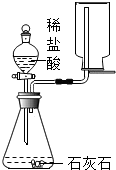 制取并收集CO2--收集CO2的方法错误 |
D、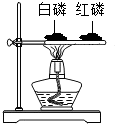 比较白磷和红磷的着火点--酒精灯加热的位置错误 |
 如图为A、B、C三种固体物质(不含结晶水)的溶解度曲线,下列说法错误的是( )
如图为A、B、C三种固体物质(不含结晶水)的溶解度曲线,下列说法错误的是( )| A、t1℃时,三种物质中B的溶解度最大 |
| B、t2℃时,取三种物质各ag分别放入l00g水中,充分溶解,只有C物质能形成饱和溶液 |
| C、将等质量的三种物质的饱和溶液分别由t2 降温到tl℃,A溶液中析出的晶体质量最大 |
| D、将三种物质的饱和溶液分别由t1℃升温到t2℃,所得溶液溶质质量分数最大的是A溶液 |
 目前,科学家提出了一种最经济最理想的获得氢能源的循环体系(如右图).下列说法错误的是( )
目前,科学家提出了一种最经济最理想的获得氢能源的循环体系(如右图).下列说法错误的是( )| A、燃料电池能够使化学反应产生的能量转化为电能 | ||||
B、.在此循环中发生了反应:2H2O
| ||||
| C、该氢能源的循环体系能够实现太阳能转化为电能 | ||||
| D、目前化学家急需解决的问题是寻找合适的光照条件下分解水的催化剂 |