题目内容
 在“侯式联合制碱法”的工艺流程中,最后一步是用加热碳酸氢钠的方法来制取纯碱.某纯碱生产厂制得的产品Na2CO3中混有少量NaHCO3.为了测定产品中Na2CO3的质量分数,取100g混合物加热(2NaHCO3
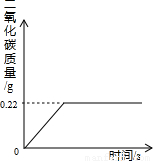
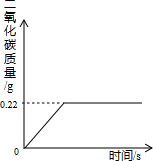
在“侯式联合制碱法”的工艺流程中,最后一步是用加热碳酸氢钠的方法来制取纯碱.某纯碱生产厂制得的产品Na2CO3中混有少量NaHCO3.为了测定产品中Na2CO3的质量分数,取100g混合物加热(2NaHCO3 Na2CO3+H2O+CO2↑,Na2CO3受热不分解),反应过程中生成二氧化碳气体的质量与反应时间的关系如图所示.
Na2CO3+H2O+CO2↑,Na2CO3受热不分解),反应过程中生成二氧化碳气体的质量与反应时间的关系如图所示.
请解答下列问题:
(1)100g混合物中NaHCO3的质量分数是多少?
(2)反应后所得碳酸钠的质量是多少?
(3)小军要配制20℃时Na2CO3的饱和溶液,查找资料,得到下表.
| 温度溶解度盐 | 10℃ | 20℃ | 30℃ | 40℃ |
| Na2CO3 | 12.5g | 21.5g | 39.7g | 49.0g |
| NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
解:(1)设混合物中NaHCO3的质量为x,同时生成碳酸钠的质量为y.则
2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
168 106 44
x y 0.22g
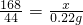
解得,x=0.84g;
 ,
,
解得,y=0.53 g
NaHCO3的质量分数为: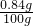 ×100%=0.84%≈0.8%;
×100%=0.84%≈0.8%;
(2)反应后所得碳酸钠的质量是:100g-0.84g+0.53 g=99.7g;
答:(1)100g混合物中NaHCO3的质量分数是0.8%;
(2)反应后所得碳酸钠的质量是99.7g;
(3)20℃时用43g Na2CO3配制成饱和溶液的质量为z,则
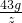 =
=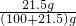 ,
,
解得,z=243g.
故填:243.
分析:(1)根据化学反应方程式2NaHCO3 Na2CO3+H2O+CO2↑可以求得参与反应的NaHCO3的质量;然后通过
Na2CO3+H2O+CO2↑可以求得参与反应的NaHCO3的质量;然后通过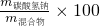 %即可求得100g混合物中NaHCO3的质量分数;
%即可求得100g混合物中NaHCO3的质量分数;
(2)利用(1)中的化学反应方程式,找到碳酸钠与二氧化碳间的比例关系即可求得所生成的碳酸钠的质量,所以mNa2CO3=m混合物-mNaHCO3+m新生成的Na2CO3;
(3)根据图表中的信息可以计算出20℃时用43g Na2CO3配制成饱和溶液的质量.
点评:本题是借助于数学模型,利用图表的方式来分析和解决化学计算中的有关问题,要求学生有较强的识图能力和数据分析能力.
2NaHCO3
 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑168 106 44
x y 0.22g
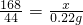
解得,x=0.84g;
 ,
,解得,y=0.53 g
NaHCO3的质量分数为:
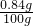 ×100%=0.84%≈0.8%;
×100%=0.84%≈0.8%;(2)反应后所得碳酸钠的质量是:100g-0.84g+0.53 g=99.7g;
答:(1)100g混合物中NaHCO3的质量分数是0.8%;
(2)反应后所得碳酸钠的质量是99.7g;
(3)20℃时用43g Na2CO3配制成饱和溶液的质量为z,则
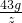 =
=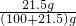 ,
,解得,z=243g.
故填:243.
分析:(1)根据化学反应方程式2NaHCO3
 Na2CO3+H2O+CO2↑可以求得参与反应的NaHCO3的质量;然后通过
Na2CO3+H2O+CO2↑可以求得参与反应的NaHCO3的质量;然后通过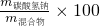 %即可求得100g混合物中NaHCO3的质量分数;
%即可求得100g混合物中NaHCO3的质量分数;(2)利用(1)中的化学反应方程式,找到碳酸钠与二氧化碳间的比例关系即可求得所生成的碳酸钠的质量,所以mNa2CO3=m混合物-mNaHCO3+m新生成的Na2CO3;
(3)根据图表中的信息可以计算出20℃时用43g Na2CO3配制成饱和溶液的质量.
点评:本题是借助于数学模型,利用图表的方式来分析和解决化学计算中的有关问题,要求学生有较强的识图能力和数据分析能力.

练习册系列答案
相关题目
 在“侯式联合制碱法”的工艺流程中,最后一步是用加热碳酸氢钠的方法来制取纯碱.某纯碱生产厂制得的产品Na2CO3中混有少量NaHCO3.为了测定产品中Na2CO3的质量分数,取100g混合物加热(2NaHCO3
在“侯式联合制碱法”的工艺流程中,最后一步是用加热碳酸氢钠的方法来制取纯碱.某纯碱生产厂制得的产品Na2CO3中混有少量NaHCO3.为了测定产品中Na2CO3的质量分数,取100g混合物加热(2NaHCO3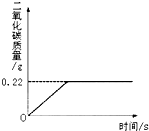 (2008?昌平区一模)在“侯式联合制碱法”的工艺流程中,最后一步是用加热碳酸氢钠的方法来制取纯碱.某纯碱生产厂制得的产品Na2CO3中混有少量NaHCO3.为了测定产品中Na2CO3的质量分数,取100g混合物加热(2NaHCO3
(2008?昌平区一模)在“侯式联合制碱法”的工艺流程中,最后一步是用加热碳酸氢钠的方法来制取纯碱.某纯碱生产厂制得的产品Na2CO3中混有少量NaHCO3.为了测定产品中Na2CO3的质量分数,取100g混合物加热(2NaHCO3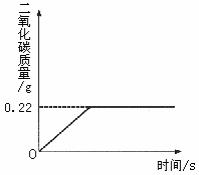
 Na2CO3+H2O+CO2↑,Na2CO3受热不分解),反应过程中生成二氧化碳气体的质量与反应时间的关系如图所示.
Na2CO3+H2O+CO2↑,Na2CO3受热不分解),反应过程中生成二氧化碳气体的质量与反应时间的关系如图所示.