题目内容
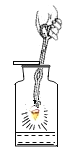
【题目】配制20%的NaCl溶液100g。
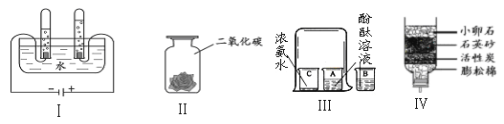
(1)①中玻璃棒的作用是_____。
(2)用托盘天平称取所需的氯化钠,发现指针向右偏转,接下来的操作是_____(填字母序号)。
A 继续添加氯化钠 B 减少砝码
(3)用量筒量取水的体积为_____mL(ρ水≈1g/cm3)。
(4)该实验的正确操作顺序为_____(填数字序号)。
【答案】搅拌,加快溶解速率 A 80 ②③④①
【解析】
(1)溶解时玻璃棒的用途是搅拌,加快溶解速率;
(2)在称量氯化钠固体的过程中,步骤应该是:先调好砝码和游码,然后向左边托盘添加固体物质;若发现指针向右偏转,说明固体物质药品的质量小于砝码的质量,故应继续向左盘添加氯化钠,直至天平平衡。
(3)溶质质量=溶液质量×溶质的质量分数,配制20%的NaCl溶液100g,需氯化钠的质量=100g×20%=20g;溶剂质量=溶液质量﹣溶质质量,则所需水的质量=100g﹣20g=80g(合80mL)。
(4)配制20%的NaCl溶液100g,首先计算配制溶液所需NaCl和水的质量,再称量所需的NaCl和量取水,最后进行溶解,故该实验的正确操作顺序为②③④①。
故答案为:(1)搅拌,加快溶解速率;(2)A;(3)80;(4)②③④①。

 字词句段篇系列答案
字词句段篇系列答案【题目】叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
(应用研究)
(1)汽车经撞击后,30毫秒内引发NaN3,迅速分解为Na、N2,反应方程式为_______。
(制备研究)
(2)将金属钠与液态氨反应得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和
气体X,该反应的化学方程式为2NaNH3+N2O = NaN3+NaOH+X,实验室检验X
气体使用的试纸是湿润________。
(Na2CO3质量分数测定)
工业级NaN3中常含有少量的Na2CO3,为测定样品中Na2CO3的质量分数设计如图装置(已知H2SO4溶液与NaN3,反应不生成气体)。
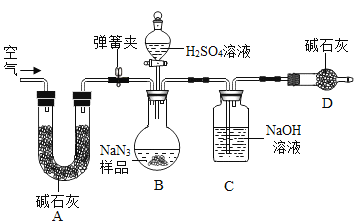
(3)装置A的作用是_____。设计的实验步骤为:①精确称量样品,检查装置气密性;②打开弹簧夹,鼓入空气,称量装置C;③关闭弹簧夹,打开分液漏斗活塞;④再打开弹簧夹,_______;⑤再次称量装置C。计算碳酸钠含量至少需要测定______(填数字)个数据。根据制备反应,分析工业级NaN3中含有Na2CO3的可能原因_______。
M |
(NaN3纯度测定)精确称量0.140 g NaN3样品,设计如图装置,测定其纯度。已知2 NaN3→ 3N2
(NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热。
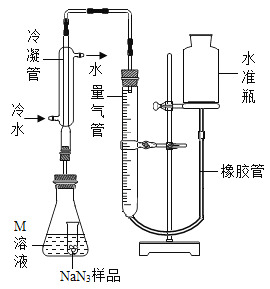
(4)检查该装置气密性的方法是连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差_____(填“变大”、“变小”或“不变”),说明气密性良好。
(5)使小试管中的NaN3样品与M溶液接触的操作是______。
(6)使用冷水冷凝的目的是______。反应前应将液面调节到量气管的“0”刻度,并使两边液面相平,反应后读数时,还需要进行的操作是_______。
(7)常温下测得量气管读数为67.2 mL(N2的密度为1.25 g/L),则实验中选用的量气管规格合适的是_____(填字母序号)。
A. 100 mL B. 1 L C. 2 L
(8)计算NaN3样品的纯度(写出计算过程)。
【题目】馒头、面包等发面食品的一个特点是面团中有许多小孔, 他们使发面食品松软可口。小明学习相关化学知识后, 将家里制作馒头用的白色粉末带到实验室与兴趣小组的同学一起进行探究。
(初步探究)取少量白色粉末于试管中, 加适量水, 测得溶液的 pH >7, 说明溶液呈________________性。
(提出问题)白色粉末成分是什么?
(查阅资料)
(1)碳酸钠、碳酸氢钠都可用于制作发面食品。
(2)碳酸氢钠不稳定, 受热易分解生成二氧化碳和水等; 碳酸钠很稳定。
(猜想与假设)
猜想Ⅰ: 碳酸钠
猜想Ⅱ: 碳酸氢钠
(实验探究)甲乙兴趣小组设计不同实验方案进行探究。
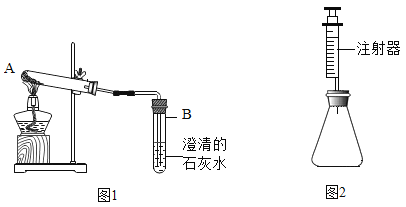
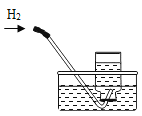
甲组方案: 如图 1取适量白色粉末于试管中, 将导管伸入澄清石灰水, 加热, 澄清石灰水变浑浊, 猜想Ⅱ正确。写出装置 B 中反应的化学方程式__________________。
乙组方案: 用如图 2 所示装置作为反应容器, 准确测量生成气体的体积以判断白色粉末的成分。分别向盛有碳酸钠、碳酸氢钠和白色粉末的锥形瓶中, 注入等体积、等浓度的足量的稀盐酸, 记录如表:
实验编号 | 锥形瓶内物质 | 最终得到 CO2 体积 /ml | |
名称 | 质量 /g | ||
① | 碳酸钠 | a | V1 |
② | 碳酸氢钠 | a | V2 |
③ | 白色粉末 | m | V3 |
实验②的化学反应方程式为______; 表中 m =____g;;根据上表中数据分析, 猜想Ⅱ正确,,判断的依据是____。
(反思应用)
(1)甲组方案中, 无法判断白色粉末是否为碳酸钠和碳酸氢钠的混合物; 乙组方案可以判断, 如果是两者的混合物, 应该满足的条件是______。
(2)家中制作馒头、面包时, 将面粉发酵 ( 产生有机酸) , 再加入适量的碳酸氢钠, 可以使馒头、面包松软。原因是_______。
【题目】下列实验指定容器中的水,其解释没有体现水的主要作用的是( )
A | B | C | D | |
实 验 装 置 |
硫在氧气中燃烧 |
测定空气中氧气含量 |
铁丝在氧气中燃烧 |
排水法收集氢气 (氢气难溶于水) |
解释 | 集气瓶中的水:吸收放出的热量 | 量筒中的水:通过水体积的变化得出O2体积 | 集气瓶中的水:冷却溅落融熔物,防止集气瓶炸裂 | 集气瓶中的水:水先将集气瓶内的空气排净,后便于观察氢气何时收集满 |
A.AB.BC.CD.D
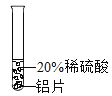
【题目】小彬同学家新买了水龙头,从说明书上了解到该水龙头是铜质镀铬的。他想起在学习金属性质时用到的金属活动性顺序中没有铬,为了了解铬与常见金属铝、铜在金属活动性顺序中的相对位置关系,进行如下探究活动。
(查阅资料)铬(Cr)是银白色有光泽的金属,在空气中表面能生成抗腐蚀性的致密氧化膜;铬能与稀硫酸反应,生成蓝色的硫酸亚铬( CrSO4)溶液……
(预 测)三种金属在金属活动性顺序中的相对位置关系:
①Cr Al Cu ②Al Cr Cu ③Al Cu Cr
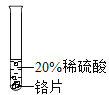
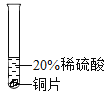
(实验过程)取大小相同的三种金属薄片,用砂纸打磨光亮。
实验一 | 实验二 | 实验三 | |
实验 方案 |
|
|
|
实验 现象 | 铬片表面产生气泡缓慢,溶液变蓝色。 | ________ | 铝片表面产生气泡较快 |
结论 | 铬能和稀硫酸发生反应,反应速率较慢。 | 铜不与稀硫酸反应 | ________ |
三种金属在金属活动性顺序中的相对位置关系是________ | |||
(回答问题)(1)用砂纸打磨金属片的目的是____________。
(2)实验三所发生反应的化学方程式是________________ ;属于_______反应(填基本反应类型)。
(3)小东提出用硫酸铜溶液代替上述实验中的稀硫酸也能得出三种金属在金属活动性顺序中的相对位置关系,小燕认为不可行,理由是___________________。
(4)小清认为只要选用一种药品进行实验就可以得出三种金属在金属活动性顺序中的相对位置关系,这一种药品可以是____________ 。
A 硫酸亚铬溶液 B 硫酸铝溶液
试写出所发生的反应的化学方程式____________________。