题目内容
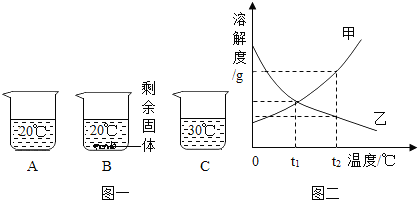
向装有等量水的A、B、C烧杯中分别加入10g、25g、25gNaNO3固体,充分溶解后,现象如图一所示.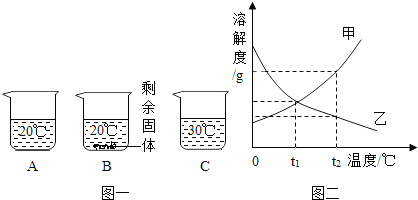
(1)烧杯中的溶液一定属于饱和溶液的是______(填序号);
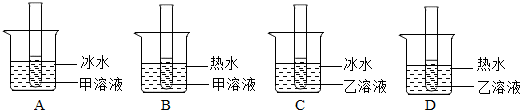
(2)图二能表示NaNO3溶解度曲线的是______(填“甲”或“乙”);
(3)由图二可知从甲的饱和溶液中提取甲,应采用的方法是______;
(4)在室温时,将盛有甲、乙两物质的饱和溶液的试管各两支,分别放入盛有冰水或热水的烧杯中.根据图二判断,下图试管内所示现象正确的是______(填序号).
(5)由图二分析,若分别将100g甲、乙的饱和溶液从t2℃降温到t1℃,对所得溶液的叙述正确的______(填序号).
Ⅰ.甲、乙都是饱和溶液
Ⅱ.所含溶剂质量:甲<乙;
Ⅲ.溶液质量:甲>乙
Ⅳ.溶质质量分数:甲>乙.
解:(1)由于在三个烧杯中只有B有未溶解的固体存在,因此B中的溶液一定是饱和溶液,故选B;
(2)由于在等量的30℃的水中全部溶解了25g硝酸钠,而20℃的水没有全部溶解25g硝酸钠,说明硝酸钠的溶解度随温度的升高而增大,故答案为:甲;
(3)根据图二甲的溶解度曲线特点:硝酸钠的溶解度随着温度的升高而增大,故要从甲的饱和溶液中提取甲,应采用的方法是冷却热饱和溶液;
(4)根据图二甲的溶解度曲线特点:硝酸钠的溶解度随着温度的升高而增大,故放入冷水时溶解度减小而会析出晶体,放入热水时溶解度增大,溶质全部溶解,故选A;
(5)Ⅰ、由于甲的溶解度随温度的降低而减小,因此它的饱和溶液降温后会有晶体析出,但溶液仍为饱和溶液;但乙的溶解度随温度的降低而增大,因此它的饱和溶液降温后就会变成不饱和溶液,故A错误;
Ⅱ、由于在降温过程中溶剂的质量并没有发生变化,因此只要比较出它们原来的溶剂的多少即可;根据两种物质的溶解度曲线可知,在t2℃时,甲的溶解度大于乙的溶解度,即饱和溶液中溶质的质量分数甲>乙,即等量的饱和溶液中溶质的质量甲>乙,则溶剂甲<乙,故B正确;
Ⅲ、由于甲溶液随着温度的降低会有晶体析出,因此溶液质量会减小,而乙的溶液中没有晶体析出溶液质量不会发生变化,因此降温后溶液的质量甲<乙,故C错误;
Ⅳ、在t1℃时,两物质的溶解度相等,即两物质的饱和溶液中溶质的质量分数相等,但乙溶液已经不再是饱和溶液,因此溶液中溶质的质量分数甲>乙,故D正确;
故选Ⅱ、Ⅳ.
故答案为:(1)B(2)甲(3)冷却热饱和溶液(4)A(5)Ⅱ、Ⅳ
分析:(1)根据溶液中是否有未溶解的溶质存在来判断溶液是否饱和;
(2)根据硝酸钠的溶解度随温度的变化确定硝酸钠的溶解度曲线;
(3)根据图二甲的溶解度曲线特点来分析从甲的饱和溶液中提取甲的方法;
(4)根据图二甲和乙的溶解度随温度的变化特点来分析;
(5)根据两种物质的溶解度曲线首先确定出在t2℃时两种物质的溶解度,从而可以确定出在t2℃时两种物质的饱和溶液中溶质的质量分数,及比较溶液中溶剂的多少;然后根据两种物质的溶解度随温度变化的情况,分析出降温至t1℃时两种物质的溶解度的大小,溶液状态的变化及溶液中各个量的变化.
点评:本题难度较大,主要考查了固体溶解度曲线所表示的意义,及根据固体的溶解度曲线解决相关的问题,从而加深学生对固体溶解度的理解和掌握.
(2)由于在等量的30℃的水中全部溶解了25g硝酸钠,而20℃的水没有全部溶解25g硝酸钠,说明硝酸钠的溶解度随温度的升高而增大,故答案为:甲;
(3)根据图二甲的溶解度曲线特点:硝酸钠的溶解度随着温度的升高而增大,故要从甲的饱和溶液中提取甲,应采用的方法是冷却热饱和溶液;
(4)根据图二甲的溶解度曲线特点:硝酸钠的溶解度随着温度的升高而增大,故放入冷水时溶解度减小而会析出晶体,放入热水时溶解度增大,溶质全部溶解,故选A;
(5)Ⅰ、由于甲的溶解度随温度的降低而减小,因此它的饱和溶液降温后会有晶体析出,但溶液仍为饱和溶液;但乙的溶解度随温度的降低而增大,因此它的饱和溶液降温后就会变成不饱和溶液,故A错误;
Ⅱ、由于在降温过程中溶剂的质量并没有发生变化,因此只要比较出它们原来的溶剂的多少即可;根据两种物质的溶解度曲线可知,在t2℃时,甲的溶解度大于乙的溶解度,即饱和溶液中溶质的质量分数甲>乙,即等量的饱和溶液中溶质的质量甲>乙,则溶剂甲<乙,故B正确;
Ⅲ、由于甲溶液随着温度的降低会有晶体析出,因此溶液质量会减小,而乙的溶液中没有晶体析出溶液质量不会发生变化,因此降温后溶液的质量甲<乙,故C错误;
Ⅳ、在t1℃时,两物质的溶解度相等,即两物质的饱和溶液中溶质的质量分数相等,但乙溶液已经不再是饱和溶液,因此溶液中溶质的质量分数甲>乙,故D正确;
故选Ⅱ、Ⅳ.
故答案为:(1)B(2)甲(3)冷却热饱和溶液(4)A(5)Ⅱ、Ⅳ
分析:(1)根据溶液中是否有未溶解的溶质存在来判断溶液是否饱和;
(2)根据硝酸钠的溶解度随温度的变化确定硝酸钠的溶解度曲线;
(3)根据图二甲的溶解度曲线特点来分析从甲的饱和溶液中提取甲的方法;
(4)根据图二甲和乙的溶解度随温度的变化特点来分析;
(5)根据两种物质的溶解度曲线首先确定出在t2℃时两种物质的溶解度,从而可以确定出在t2℃时两种物质的饱和溶液中溶质的质量分数,及比较溶液中溶剂的多少;然后根据两种物质的溶解度随温度变化的情况,分析出降温至t1℃时两种物质的溶解度的大小,溶液状态的变化及溶液中各个量的变化.
点评:本题难度较大,主要考查了固体溶解度曲线所表示的意义,及根据固体的溶解度曲线解决相关的问题,从而加深学生对固体溶解度的理解和掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目