题目内容
【题目】空气中氧气含量测定的再认识。
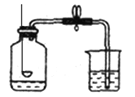
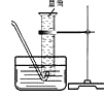
【实验回顾】实验室常用红磷燃烧的方法测定空气中氧气的含量(装置如图),写出红磷燃烧的反应表达式为 。
兴趣小组用该方法测出的氧气含量常常远低于21%。
【提出问题】用红磷燃烧的方法为什么不能准确地测定空气中氧气 的含量?
【问题分析】(1)装置漏气;
(2) ,装置内氧气有剩余;……
【问题拓展】镁在空气中燃烧的化学表达式为 ,已知镁条除了和氧气反应,还可以和氮气、二氧化碳发生反应。镁和氮气反应的生成物为Mg3N2,其中氮元素的化合价为 价;镁在二氧化碳中点燃后生成白色固体氧化镁和一种黑色单质,该反应表达式为 ,因此仓库内的镁条着火, (填“能”或“不能”)用二氧化碳灭火。探究空气中氧气含量的实验中,若将燃烧匙中的药品换成镁粉,实验结束后,测量得到的结果 (填“偏大”、“偏小”或“无影响”)。
【答案】【实验回顾】P+O2![]() P2O5
P2O5
【问题分析】(2)红磷量不足
【问题拓展】Mg+O2![]() MgO -3
MgO -3
Mg+CO2![]() MgO+C 不能 偏大
MgO+C 不能 偏大
【解析】
试题分析:【实验回顾】磷和氧气在点燃条件下生成五氧化二磷P+O2![]() P2O5
P2O5
【问题分析】(2)测定氧气的含量偏低的原因有,装置的气密性不好,红磷量不足,没冷却到室温就读数等
【问题拓展】镁和氧气在点燃条件反应生成氧化镁Mg+O2![]() MgO-;化合物中元素的化合价代数和为零,镁元素显+2价,所以氮元素为-3价;Mg+CO2
MgO-;化合物中元素的化合价代数和为零,镁元素显+2价,所以氮元素为-3价;Mg+CO2![]() MgO+C,镁着火时,不能用二氧化碳灭火;镁能和空气中多种物质反应,故测定结果偏大
MgO+C,镁着火时,不能用二氧化碳灭火;镁能和空气中多种物质反应,故测定结果偏大

练习册系列答案
 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目