题目内容
【题目】向Mg(NO3)2、Cu(NO3)2、AgNO3的混合溶液中加入一定量的铁粉并充分反应,得“滤渣”和“滤液”。
(1) Mg. Cu. Ag. Fe四种金属的活动性由强到弱的顺序是_________________。
(2)往“滤渣”中加入盐酸,若无明显规象,则可能发生的反应化学方程式为_______________。
(3)往“滤渣”中加入盐酸,若有气泡产生,则“滤液”中一定有的溶质是_______________。
【答案】Mg、Fe、Cu、Ag ![]() Fe(NO3)2、Mg(NO3)2
Fe(NO3)2、Mg(NO3)2
【解析】
向Mg(NO3)2、Cu(NO3)2、AgNO3的混合溶液中加入一定量的铁粉并充分反应,铁先与硝酸银反应生成硝酸亚铁和银,待硝酸银完全反应后,铁再与硝酸铜反应生成硝酸亚铁和铜,铁与硝酸镁不反应。
(1)金属活动性顺序:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au。在金属活动性顺序里,金属的位置越靠前,它的活动性就越强,故Mg、Cu、Ag、Fe四种金属的活动性由强到弱的顺序是:Mg、Fe、Cu、Ag;
(2)往“滤渣”中加入盐酸,无明显现象,说明铁粉已经完全反应,铁粉完全反应,铁首先和硝酸银反应发生的反应为:![]() ,铁也有可能置换了部分硝酸铜或恰好和硝酸铜完全反应,这时发生的反应为:
,铁也有可能置换了部分硝酸铜或恰好和硝酸铜完全反应,这时发生的反应为:![]() 、
、![]() ,故一定发生的反应为:
,故一定发生的反应为:![]() ,可能发生的反应为:
,可能发生的反应为:![]() ,故填:
,故填:![]() ;
;
(3)往“滤渣”中加入盐酸,若有气泡产生,说明铁粉有剩余,铁已经将硝酸银和硝酸铜完全置换,![]() 、
、![]() ,Mg(NO3)2不参与反应,故滤液中一定有的溶质是:Fe(NO3)2、Mg(NO3)2。
,Mg(NO3)2不参与反应,故滤液中一定有的溶质是:Fe(NO3)2、Mg(NO3)2。

 寒假学与练系列答案
寒假学与练系列答案【题目】中医药是中华文明的重要组成部分。中医药在2020抗击新冠肺炎“战疫”中起重要的作用。初中常见的很多化学物质都是中医常用的药物。芒硝的主要成分是硫酸钠,在中医药中常用于湿热积滞、腹满胀痛、大便燥结等病症治疗。芒硝广泛分布于我国各地,尤其以盐碱地分布较多。
小青和小竹在了解芒硝的基本信息后,准备用盐湖水制备少量的Na2SO4晶体。
[查阅资料]
I.盐湖水中的溶质是NaCl、Na2CO3和Na2SO4.
II. NaCl、Na2CO3和Na2SO4在水中不同温度下的溶解度如下表所示:
0°C | 10°C | 20°C | 30°C | 40°C | |
NaCl | 35.7g | 35.8g | 36.0g | 36.3g | 36.6g |
Na2CO3 | 7g | 12.2g | 21.8g | 39.7g | 48.8g |
Na2SO4 | 4.9g | 9.1g | 19.5g | 40.8g | 48.8g |
(1)若要证明盐湖水中含有NaCl、Na2CO3 和Na2SO4,可依次加入适量的__________(选填字母),看到相应现象即可证明.
A AgNO3、H2SO4、BaCl2
B HCl、Ba(NO3)2、AgNO3
C HNO3、Ba(NO3)2、AgNO3
[进行实验]用盐湖水制取少量Na2SO4晶体
小青方案 | 取少盐湖水,蒸发浓缩,降温结晶,过滤,洗涤,干燥 |
[实验讨论]
(2)同学们讨论后认为小青的方案存在问题,因为用小青的方案得到的晶体除了含有硫酸钠外,还含有____晶体杂质。小竹在小青方案的基础上进行了改进,从而达到实验目的,
(3)小青的实验方案中“洗涤晶体”这一操作最好使用饱和_____________溶液洗而不用水洗,以防止硫酸钠固体溶于水造成晶体的损失。
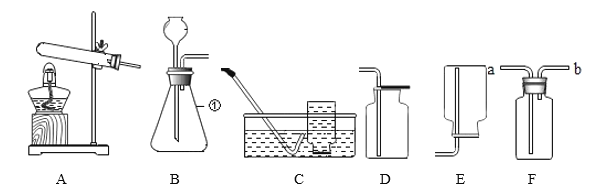
[实验拓展]小湖同学想通过实验测得一定质盐湖水中Na2CO3的溶质质量分数,设计了下图所示装置进行实验,通过测定装D中氢氧化钠溶液的质量变化。然后计算,从而达到实验目的。
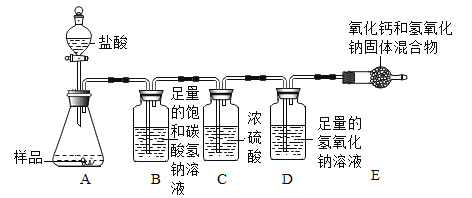
(4)装置B的作用是:_______________________。
(5)若将装置C和D颠倒位置,则通过计算得出Na2CO3的溶质质量分数__________ (填“偏大”、 “偏小”或“无影响”) .