题目内容
Cu与Zn 称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件.某化学兴趣小组的同学为了测定某黄铜的组成,取40g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应.每次所用稀硫酸的质量及剩余固体的质量记录于下表:
| 加入稀硫酸的质量(g) | 充分反应后剩余固体的质量(g) | |
| 第1次 | 40 | 34.8 |
| 第2次 | 40 | 29.6 |
| 第3次 | 40 | 24.4 |
| 第4次 | 40 | 24.0 |
| 第5次 | 40 | m |
(1)上述表格中m的值为______,
(2)黄铜样品中锌的质量分数是多少?
解:(1)根据质量守恒定律,由第1次实验数据可知,每加入40g稀硫酸完全反应可消耗金属的质量为:40g-34.8g=5.2g,据此分析,第4次加入40g稀硫酸时消耗金属的质量为24.4g-24.0g=0.4g<5.2g,可判断此时合金中金属锌已完全反应,所以,第5次加入的稀硫酸不再发生反应,因此充分反应后剩余固体的质量仍为24.0g;
(2)黄铜样品中锌的质量分数=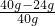 ×100%=40%;
×100%=40%;
答:黄铜样品中锌的质量分数是40%.
分析:(1)分析反应及实验数据:根据金属活动性,合金中只有锌可以与硫酸反应;根据质量守恒定律,由第1次实验数据可知,每加入40g稀硫酸完全反应可消耗金属的质量为:40g-34.8g=5.2g,据此分析,第4次加入40g稀硫酸时消耗金属的质量为24.4g-24.0g=0.4g<5.2g,可判断此时合金中金属锌已完全反应,所以,第5次加入的稀硫酸不再发生反应,故可以判断出m的值;
(2)使用金属锌完全反应时剩余固体铜的质量,计算样品中金属锌的质量,利用锌的质量与样品的质量比计算黄铜样品中锌的质量分数.
点评:本题主要考查合金中金属与酸的反应及合金中金属质量分数的计算等,学生应能利用表格进行数据分析和应用.
(2)黄铜样品中锌的质量分数=
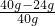 ×100%=40%;
×100%=40%;答:黄铜样品中锌的质量分数是40%.
分析:(1)分析反应及实验数据:根据金属活动性,合金中只有锌可以与硫酸反应;根据质量守恒定律,由第1次实验数据可知,每加入40g稀硫酸完全反应可消耗金属的质量为:40g-34.8g=5.2g,据此分析,第4次加入40g稀硫酸时消耗金属的质量为24.4g-24.0g=0.4g<5.2g,可判断此时合金中金属锌已完全反应,所以,第5次加入的稀硫酸不再发生反应,故可以判断出m的值;
(2)使用金属锌完全反应时剩余固体铜的质量,计算样品中金属锌的质量,利用锌的质量与样品的质量比计算黄铜样品中锌的质量分数.
点评:本题主要考查合金中金属与酸的反应及合金中金属质量分数的计算等,学生应能利用表格进行数据分析和应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件.某化学兴趣小组的同学为了测定某黄铜的组成,取20g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应.每次所用稀硫酸的质量及剩余固体的质量记录于下表:
试回答下列问题:
(1)网上述表格中m的值为 ;
(2)黄铜样品中锌的质量分数为 ;
(3)所用稀硫酸中硫酸的质量分数是多少? .
| 加入稀硫酸的质量(g) | 充分反应后剩余固体的质量(g) | |
| 第1次 | 20 | 17.4 |
| 第2次 | 20 | 14.8 |
| 第3次 | 20 | 12.2 |
| 第4次 | 20 | 12.0 |
| 第5次 | 20 | m |
(1)网上述表格中m的值为
(2)黄铜样品中锌的质量分数为
(3)所用稀硫酸中硫酸的质量分数是多少?
