题目内容
【题目】构建模型和构建知识网络是化学学习中重要的学习方法,李华同学利用左手构建酸的性质知识网络,如图所示,请结合图示回答下列问题:
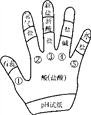
(1)如用湿润的pH试纸测定盐酸的pH,则结果会________(填“偏大”“偏小”或“无影响”)。
(2)图中①的现象是____________。
(3)写出一个符合图中③的化学方程式_____________________________________。
(4)图中性质④属于________反应(填基本反应类型)。
(5)图中⑤的性质在工业上可用于____________(填用途)。
【答案】 偏大 石蕊变红 HCl+AgNO3=AgCl↓+HNO3(合理即可) 复分解 除铁锈(合理即可)
【解析】(1)如用湿润的pH试纸测定盐酸的pH,会导致酸被稀释,溶液的酸性变弱,则结果会偏大;(2)酸性溶液能使紫色石蕊试液变红,图中①的现象是紫色石蕊试液变红;(3)图中③表示的是酸和盐生成新的酸和新的盐,硝酸银属于盐,能与盐酸反应生成硝酸和氯化银沉淀,反应化学方程式HCl+AgNO3=AgCl↓+HNO3。(4)图中性质④表示酸和碱生成盐和水,属于复分解反应;(5)图中⑤表示的是酸和金属氧化物反应生成盐和水,在工业上可用于除铁锈。

【题目】已知氯化钠、碳酸钠在不同温度时的溶解度如表:
温度/℃ | 0 | 10 | 20 | 30 | 40 | |
溶解度/g | 氯化钠 | 35 | 35.5 | 36 | 36.5 | 37 |
碳酸钠 | 6 | 10 | 18 | 36.5 | 50 | |
(1)依据上表,绘制了氯化钠和碳酸钠的溶解度曲线(如图),图中能表示碳酸钠溶解度曲线的是 (填“A”或“B”);

(2)图中两溶解度曲线相交于M点,此点表示的意义是 ;
(3)40℃时,把50g A物质放入100g水中,充分搅拌,所得溶液是 (填“饱和”或“不饱和”)溶液;
(4)生活在盐湖(湖水中溶解有较多的氯化钠和碳酸钠)附近的人们习惯“夏天晒盐(NaCl),冬天捞碱(Na2CO3)”.请你答出“冬天捞碱”的道理: .
【题目】实验室有一瓶碳酸钙和氯化钙粉末组成的均匀混合物,小科用相同溶质质量分数的稀盐酸和该混合物反应(所得溶液均为不饱和溶液),四组实验数据记录如下表,请分析计算:
实验组别 | 一 | 二 | 三 | 四 |
稀盐酸质量/g | 100.0 | 100.0 | 100.0 | 100.0 |
混合物质量/g | 3.0 | 6.0 | 9.0 | 12.0 |
所得溶液质量/g | 101.9 | 103.8 | 105.0 | a |
剩余固体质量/g | 0 | 0 | m | n |
(1)反应后,稀盐酸还有剩余的是第________组;
(2)求混合物中碳酸钙和氯化钙的质量之比________;
(3)求表中a的值为________;
(4)求表中m的值____。