题目内容
某老师在课堂上进行一个演示实验,取一小块生石灰加入到盛有100mL澄清饱和石灰水烧杯中,同学们可观察到现象是溶液由澄清变为浑浊且温度升高,静置一段时间后浑浊变为澄清并恢复到室温(设整个实验过程水无蒸发).

(1)上述3位同学回答有错误的是________;
(2)你的观点是________;
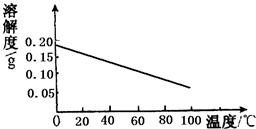
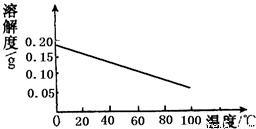
(3)根据右图Ca(OH)2的溶解度曲线上述实验中冷却至室温过程Ca(OH)2固体的质量________(填增大、不变、减小);
(4)小红往上述烧杯中进行通入二氧化碳气体的实验,观察到现象是先沉淀不断增多,然后出现沉淀减少,最终成为无色澄清溶液.写出有关反应的化学方程式:________.
解:(1)陈军的说法不正确,因为析出固体后的溶液仍然是饱和溶液.故填:陈军.
(2)析出固体后的溶液仍然是饱和溶液.故填:仍为饱和溶液.
(3)由图中可知,氢氧化钙的溶解度随着温度的降低而增大,在降温的过程中氢氧化钙不断溶解.故填:减小.
(4)氢氧化钙和二氧化碳反应生成沉淀碳酸钙,碳酸钙与水和二氧化碳反应生成溶于水的碳酸氢钙.相关反应的化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O,CaCO3+CO2+H2O=Ca(HCO3)2
分析:生石灰溶于水放热,能和水反应生成氢氧化钙,析出固体后的溶液仍然是饱和溶液,氢氧化钙和二氧化碳反应生成沉淀碳酸钙,碳酸钙与水和二氧化碳反应生成溶于水的碳酸氢钙.
点评:解答本题的关键是要掌握化学方程式的书写方法、饱和溶液和不饱和溶液相互转化的关系,只有这样才能对问题做出正确的判断.
(2)析出固体后的溶液仍然是饱和溶液.故填:仍为饱和溶液.
(3)由图中可知,氢氧化钙的溶解度随着温度的降低而增大,在降温的过程中氢氧化钙不断溶解.故填:减小.
(4)氢氧化钙和二氧化碳反应生成沉淀碳酸钙,碳酸钙与水和二氧化碳反应生成溶于水的碳酸氢钙.相关反应的化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O,CaCO3+CO2+H2O=Ca(HCO3)2
分析:生石灰溶于水放热,能和水反应生成氢氧化钙,析出固体后的溶液仍然是饱和溶液,氢氧化钙和二氧化碳反应生成沉淀碳酸钙,碳酸钙与水和二氧化碳反应生成溶于水的碳酸氢钙.
点评:解答本题的关键是要掌握化学方程式的书写方法、饱和溶液和不饱和溶液相互转化的关系,只有这样才能对问题做出正确的判断.

练习册系列答案
相关题目