题目内容
【题目】氯化钠和氯化镁是重要的化工原料.某粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4等物质,为了从中提取较纯的氯化镁和氯化钠,设计如图实验方案: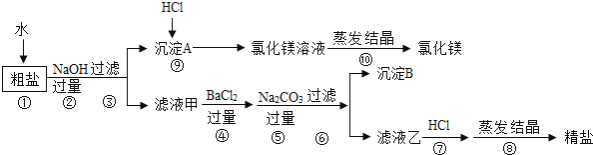
请回答下列问题:
(1)步骤①溶解过程中用玻璃棒搅拌的目的是 .
(2)步骤④⑤的顺序颠倒会引发的后果是 .
(3)滤液乙中所含的溶质除氯化钠外还含有;沉淀B中除含碳酸钙、碳酸钡外还含有;在步骤⑦中若加入的盐酸略过量是否对实验结果有影响原因是 .
(4)写出步骤⑨中反应的化学方程式 .
(5)实验最终所得的精盐的质量大于粗盐中氯化钠的质量,整个过程中产生新的NaCl的反应共有个.
【答案】
(1)加速溶解
(2)精盐中会混有氯化钡
(3)碳酸钠和氢氧化钠;硫酸钡;无影响;蒸发时氯化氢气体挥发掉
(4)Mg(OH)2+2HCl=MgCl2+2H2O
(5)6
【解析】解:正确的操作步骤为:
①将粗盐溶于足量水中制成溶液;
②向溶液中加入足量的NaOH溶液,除去Mg2+ , 反应的方程式为:2NaOH+MgCl2=Mg(OH)2↓+2NaCl,过滤,除去滤渣;
③向上述溶液中加入足量的BaCl2溶液,除去SO42﹣ , 反应的化学方程式为:Na2SO4+BaCl2=BaSO4↓+2NaCl;
④向上述滤液中加入足量的Na2CO3溶液,除去Ca2+、Ba2+ , 反应的方程式为:Na2CO3+CaCl2=CaCO3↓+2NaCl,Na2CO3+BaCl2=BaCO3↓+2NaCl;
⑤向④滤液中滴加稀盐酸,调节PH=7,除去CO32﹣和OH﹣ , 反应的化学方程式为:Na2CO3+2HCl=H2O+CO2↑+2NaCl,NaOH+HCl=NaCl+H2O;
⑥将NaCl溶液蒸发,洗涤干燥,即得较纯净的食盐;
其中加入氢氧化钠的顺序中,只要放在过滤之前即可,加入碳酸钠溶液必须放在加入氯化钡溶液之后,否则多余的钡离子无法除去,(1)溶解过程中用玻璃棒搅拌的目的是加速溶解;(2)加入的氯化钡用来除去SO42﹣ , 加入的碳酸钠用来除去Ca2+和过量的钡离子;加入的碳酸钠溶液应该放在氯化钡溶液之后,否则多余的钡离子无法除去;(3)根据上述除杂过程可知,由于加入的碳酸钠与氢氧化钠都是过量的,故滤液乙中所含的溶质除氯化钠外还含有碳酸钠和氢氧化钠;加入的氯化钡会与粗盐中的硫酸钠反应生成硫酸钡沉淀,故沉淀B中除含碳酸钙、碳酸钡外还含有硫酸钡;(4)在步骤⑦中若加入的盐酸略过量,不会对实验结果造成影响,因为盐酸具有挥发性,蒸发时氯化氢气体挥发掉;(5)根据上述除杂过程中的化学反应可知,整个过程中产生新的NaCl的反应共有6个.
所以答案是:(1)加速溶解;(2)精盐中会混有氯化钡;(3)碳酸钠和氢氧化钠;硫酸钡;无影响,蒸发时氯化氢气体挥发掉;(4)Mg(OH)2+2HCl=MgCl2+2H2O;(5)6.
【考点精析】利用过滤操作的注意事项和书写化学方程式、文字表达式、电离方程式对题目进行判断即可得到答案,需要熟知过滤操作注意事项:“一贴”“二低”“三靠;过滤后,滤液仍然浑浊的可能原因有:①承接滤液的烧杯不干净②倾倒液体时液面高于滤纸边缘③滤纸破损;注意:a、配平 b、条件 c、箭号.

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案【题目】向烧杯中逐滴加入x溶液至过量(图甲),生成沉淀或气体的质量与加入x溶液的质量关系符合图乙的是( )
烧杯中的物质 | x溶液 | |
A | 稀盐酸和硫酸铜溶液 | 烧碱溶液 |
B | 稀硫酸和稀盐酸 | 氯化钡溶液 |
C | 硝酸银溶液和稀硝酸 | 氯化钠溶液 |
D | 氯化钠和碳酸氢钠溶液 | 稀盐酸 |

A.A
B.B
C.C
D.D