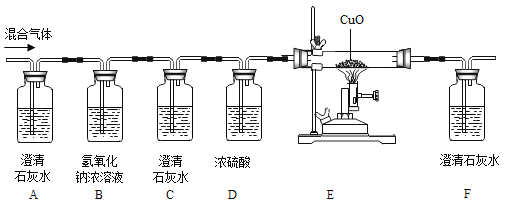
题目内容
【题目】为了能更直观地了解原子内部微粒之间的关系,化学中常以![]() 来表示原子的组成,A表示相对原子质量,Z表示质子数。据此填空:
来表示原子的组成,A表示相对原子质量,Z表示质子数。据此填空:
(1) ![]() 的质子数为______、中子数为________、电子数为________、相对原子质量为________。
的质子数为______、中子数为________、电子数为________、相对原子质量为________。
(2)![]() 3+的核电荷数为________、中子数为________、电子数为________、相对原子质量为________。
3+的核电荷数为________、中子数为________、电子数为________、相对原子质量为________。
(3)![]() -的质子数为________、中子数为______、电子数为________、相对原子质量为________。
-的质子数为________、中子数为______、电子数为________、相对原子质量为________。
【答案】222622481314102717181835
【解析】
根据题干信息以及原子内部微粒间的关系分析;在原子中质子数=核电荷数=核外电子数=原子序数,以及相对原子质量≈质子数+中子数判断。
(1)由题意可知,![]() 的质子数为22、中子数为48-22=26、电子数=质子数=22、相对原子质量为48。
的质子数为22、中子数为48-22=26、电子数=质子数=22、相对原子质量为48。
(2)![]() 3+的核电荷数=质子数=13、中子数为27-13=14、电子数=质子数-3=10、相对原子质量为27。
3+的核电荷数=质子数=13、中子数为27-13=14、电子数=质子数-3=10、相对原子质量为27。
(3)![]() -的质子数为17、中子数为35-17=18、电子数=质子数+1=18、相对原子质量为35。
-的质子数为17、中子数为35-17=18、电子数=质子数+1=18、相对原子质量为35。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目