题目内容
废干电池内的黑色固体含有MnO2、ZnCl2、NH4Cl、C(少量)等物质.化学小组欲通过以下流程,分离并回收部分物质.回答相关问题;
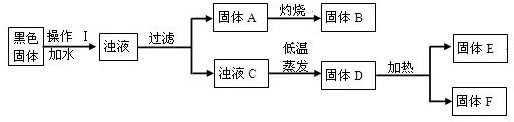
(1)玻璃棒在操作I中的作用:
(2)过滤后,滤液C仍然浑浊,则造成浑浊的原因可能是
A.滤纸破损 B.过滤过程中滤液的液面超过了滤纸的边缘
C.烧杯不干净 D.滤波C中的物质相互反应
(3)固体B常用作催化剂,则B是
(4)仅用硝酸银溶液

(1)玻璃棒在操作I中的作用:
搅拌
搅拌
.(2)过滤后,滤液C仍然浑浊,则造成浑浊的原因可能是
ABC
ABC
(填编号).A.滤纸破损 B.过滤过程中滤液的液面超过了滤纸的边缘
C.烧杯不干净 D.滤波C中的物质相互反应
(3)固体B常用作催化剂,则B是
MnO2
MnO2
(填化学式),写出在空气中灼烧A时发生反应的化学方程式:C+O2
CO2
| ||
C+O2
CO2
.
| ||
(4)仅用硝酸银溶液
不能
不能
(填“能”或“不能”)区分E和F.某同学认为固体E是NH4Cl,则检验方法是:取少量E加入适量熟石灰(或其他强碱),并加热,若闻到刺激性气味的气体,则E为NH4Cl
取少量E加入适量熟石灰(或其他强碱),并加热,若闻到刺激性气味的气体,则E为NH4Cl
.分析:(1)玻璃棒在操作I中搅拌,加速溶解;
(2)过滤时若滤液仍然浑浊,则可能的原因有①滤纸破损,②滤纸边缘高于漏斗边缘,③待过滤的液体高于滤纸边缘,④漏斗未洗干净,⑤盛放滤液的烧杯未洗干净.
(3)固体A是MnO2和C,灼烧此混合物时,C要与空气中的氧气反应生成CO2,即C+O2
CO2,所以B是MnO2.
(4)E和F是NH4Cl和ZnCl2,均含有Cl-,所以AgNO3不能区分它们,可以用强碱检验E是否是NH4Cl,原理为:取少量E加入适量熟石灰,并加热,若闻到刺激性气味的气体,则E为NH4Cl.
(2)过滤时若滤液仍然浑浊,则可能的原因有①滤纸破损,②滤纸边缘高于漏斗边缘,③待过滤的液体高于滤纸边缘,④漏斗未洗干净,⑤盛放滤液的烧杯未洗干净.
(3)固体A是MnO2和C,灼烧此混合物时,C要与空气中的氧气反应生成CO2,即C+O2
| ||
(4)E和F是NH4Cl和ZnCl2,均含有Cl-,所以AgNO3不能区分它们,可以用强碱检验E是否是NH4Cl,原理为:取少量E加入适量熟石灰,并加热,若闻到刺激性气味的气体,则E为NH4Cl.
解答:解:该实验流程为:黑色固体
浊液
(1)操作I是溶解固体的操作,所以玻璃棒起搅拌作用,以加速固体的溶解速度;
(2)A、若滤纸破损,液体会不经过滤纸而直接流入接受滤液的烧杯中,造成滤液仍浑浊.
B、若滤液的液面超过了滤纸的边缘,则液体就从滤纸和漏斗的空隙中流过,造成滤液仍浑浊.
C、接受滤液的烧杯不干净也会造成滤液浑浊.
D、滤液C中的物质根本不会反应,若会反应在过滤前早就反应了.
(3)因为MnO2和C不溶于水,所以固体A是MnO2和C的混合物,再灼烧时,C会与空气中的氧气反应生成CO2,即C+O2
CO2,最后剩下的是MnO2.
(4)因为NH4Cl会与强碱在加热的条件下反应生成NH3,NH3有刺激性气味,所以强碱可以鉴别E是否是NH4Cl.
故答案是:(1)搅拌;
(2)ABC;
(3)MnO2;C+O2
CO2;
(4)不能;取少量E加入适量熟石灰(或其他强碱),并加热,若闻到刺激性气味的气体,则E为NH4Cl;
| 水 |
| 过滤 |
|
(1)操作I是溶解固体的操作,所以玻璃棒起搅拌作用,以加速固体的溶解速度;
(2)A、若滤纸破损,液体会不经过滤纸而直接流入接受滤液的烧杯中,造成滤液仍浑浊.
B、若滤液的液面超过了滤纸的边缘,则液体就从滤纸和漏斗的空隙中流过,造成滤液仍浑浊.
C、接受滤液的烧杯不干净也会造成滤液浑浊.
D、滤液C中的物质根本不会反应,若会反应在过滤前早就反应了.
(3)因为MnO2和C不溶于水,所以固体A是MnO2和C的混合物,再灼烧时,C会与空气中的氧气反应生成CO2,即C+O2
| ||
(4)因为NH4Cl会与强碱在加热的条件下反应生成NH3,NH3有刺激性气味,所以强碱可以鉴别E是否是NH4Cl.
故答案是:(1)搅拌;
(2)ABC;
(3)MnO2;C+O2
| ||
(4)不能;取少量E加入适量熟石灰(或其他强碱),并加热,若闻到刺激性气味的气体,则E为NH4Cl;
点评:此题属于综合性实验题,做此题的前提是理清实验流程,若不理解实验流程,下面的题目很多是不会做出来的.此题较难,需要同学们基础知识扎实.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目


