题目内容
【题目】往200gFeCl3和CuCl2的混合溶液中加入铁粉。己知反应的先后顺序和化学方程式分别为:2FeCl3 + Fe = 3FeCl2 CuCl2 + Fe = FeCl2 + Cu 。下图为加入铁粉的质量与反应后剩余固体质量关系。则下列说法不正确的是
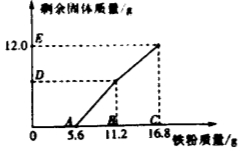
A.B点后溶液的颜色为蓝色
B.D点对应纵坐标为6.4
C.该200g溶液中的CuCl2 质量分数为6.75%
D.取DE两点间的剩余固体加入盐酸,均有气泡产生
【答案】A
【解析】
试题分析:A、根据题干信息,反应至B点,两个反应都结束,故B点后溶液为FeCl2溶液,颜色为浅绿色,错误,B、D点表示的是第二个反应前后完全反应,得到的固体全是生成的铜,故可根据化学反应:CuCl2 + Fe = FeCl2 + Cu中Fe与Cu的质量关系=56:64,从图中可看出,消耗铁的质量=11.2g-5.6g=5.6g,故生成的铜的质量为6.4,即对应纵坐标为6.4,正确,C、同样根据化学反应:CuCl2 + Fe = FeCl2 + Cu中Fe与CuCl2的质量关系=56:135,可计算出CuCl2的质量=13.5g,故该200g溶液中的CuCl2 质量分数=13.5g /200g×100%=6.75%,正确,D,根据图示,反应进行到B,两个反应都完全反应,DE两点间的剩余固体是铜和铁的混合物,故加入盐酸,均有气泡产生,正确,故选A

练习册系列答案
 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目